système anti-oxydant/systèmes anti-oxydants
Les systèmes de défense de l’organisme contre l’activité des DROs sont multiples et complexes et comprennent soit des systèmes de prévention qui empêchent la formation des DROs soit des systèmes de réparation ou d’élimination des cibles biologiques endommagées par les DROs.
Les principaux mécanismes impliqués dans la prévention de l’activité des anti -oxydants sont :
- de transformer les DROs en espèces moins toxiques
- d’empêcher l’interaction entre espèces chimiques
- de prévenir ou réparer les lésions induites par les DROs
Ces systèmes peuvent être soit enzymatiques, soit moléculaires. Ils peuvent être d’origine endogènes ou exogènes et peuvent être des composés naturels ou synthétiques.
Les systèmes enzymatiques anti-oxydants
Les superoxydes dismutases
Les superoxydes dismutases (SOD) sont des métalloprotéines responsable de la dismutation spontanée du radical superoxyde en peroxyde d’hydrogène selon la réaction suivante :
Elles sont de trois types :
-* une SOD à cuivre et à zinc (Cu,Zn-SOD), intracellulaire, située dans le cytoplasme et dans l’espace intermembranaire des mitochondries ; elle remplit une action antioxydante importante dans l’espace intermembranaire mitochondrial où il y a une accumulation importante de protons. En effet, les O2•- entrants dans cet espace seront immédiatement dismutés par la Cu,Zn-SOD afin d’éviter la formation des radicaux plus réactifs, les HO2·. Cette action antioxydante évite l’oxydation des acides gras polyinsaturés, et par conséquent protège des réactions en chaîne dans cette partie cellulaire riche en lipides
insaturés.
-* une autre SOD à cuivre et à zinc est extracellulaire principalement dans la matrice extracellulaire des tissus et à un degré moindre dans les liquides extracellulaires des tissus (plasma, lymphe) ; elle joue un rôle important dans la protection des surfaces cellulaires et des protéines de la matrice extracellulaire contre l’action des O2•- ,
-* une SOD à manganèse (Mn-SOD) qui est située à la fois dans la matrice et au niveau de la membrane interne de la mitochondrie.
-* Le peroxyde d’hydrogène formé peut être à son tour éliminé par deux autres enzymes : la catalase et la gluthathion peroxydase . ([superoxyde dismutase wikipedia-<http://fr.wikipedia.org/wiki/Superoxyde_dismutase])
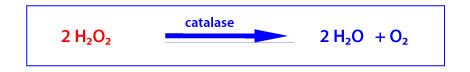
La catalase
La catalase est une enzyme héminique composée de quatre chaînes polypeptidiques. Son site catalytique permet l’élimination du peroxyde d’hydrogène, présent à haute concentration, selon la réaction globale suivante (k = 2.107 L.mol-1.s-1) :
Quatre molécules de NADPH, liées à la catalase, confèrent à cette enzyme une protection contre l’attaque de H2O2 ou comme source de NADPH pour la glutathion peroxydase. Son activité est particulièrement abondante dans les globules rouges, le foie et les reins. La catalase joue un rôle important dans la détoxication de H2O2 dans les peroxysomes .
La gluthathion peroxydase
La gluthathion peroxydase est une enzyme dépendante du sélénium qui a une forte affinité pour le peroxyde d’hydrogène ; elle permet donc l’élimination du peroxyde d’hydrogène, même présent à faible concentration, selon la réaction suivante :
Le maintien de l’activité de la GPx nécessite la régénération du gluthathion (GSH ) assurée par la glutathion réductase selon la réaction :
Les antioxydants non enzymatiques endogènes
Ils existent de nombreux réducteurs endogènes participant à la protection de l’organisme contre les DROs, les plus importants étant le gluthathion, la bilirubine, l’acide urique , le coenzyme Q, les oestrogènes, la mélanine , la mélatonine et l’acide lipoique.
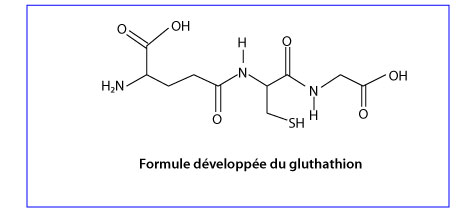
Le gluthation
Le gluthathion (GSH) est un tripeptide composé de trois acides aminés : l’acide L-Glutamique, la LCystéine et la L-Glycine.
Le site principal de la synthèse du GSH au niveau cellulaire est le cytosol, à partir duquel il est distribué aux autres compartiments cellulaires. Le GSH est synthétisé par l’action séquentielle de la glutamate-cystéine ligase et la glutathion synthétase.
Il est présent en grande quantité dans les organes exposés aux toxines tels que les reins, le foie, les poumons ou les intestins et peu présent dans les fluides biologiques. Le GSH joue un rôle primordial dans les cellules où il participe à la synthèse des protéines et de l’ADN, au transport des acides aminés et plus généralement à la détoxification cellulaire. Enfin, le GSH permet la réduction du peroxyde d’hydrogène en eau selon une réaction catalysée par la glutathion peroxydase.
Dans les tissus et le plasma, le GSH se trouve sous différentes formes :
- forme réduite dite aussi forme thiol (GSH),
- forme oxydée dite aussi forme disulfure qui est due à la liaison de 2 GSH par un pont disulfure
- et des formes mixtes appelées aussi disulfures mixtes (GSSR) produites suite à l’interaction du GSH avec d’autres thiols.
GSH est le thiol intracellulaire majoritaire. Dans les conditions physiologiques normales, il est présent essentiellement sous sa forme réduite. La mesure du taux GSH/GSSG est une bonne méthode pour évaluer le stress oxydant dans l’organisme.
Le potentiel antioxydant du gluthathion est du à son habilité à donner l’hydrogène ce qui lui permet de réduire les radicaux libres, et certaines espèces réactives telles que HOCl et ONOO–. GSH est aussi capable de chélater les ions cuivreux et ferreux, ce qui inhibe la réaction de Fenton. In vivo, GSH constitue ainsi la première ligne de défense contre la toxicité des métaux.(guthathion wikipedia)
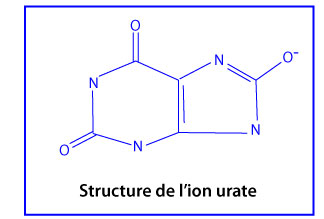
L’acide urique
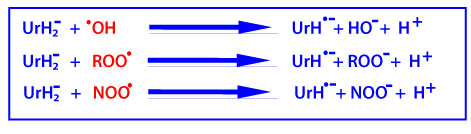
L’acide urique est formé suite à l’oxydation de l’hypoxanthine et de la xanthine par la xanthine oxydase (voir ci-dessus). réducteur. Dans les conditions physiologiques, l’acide urique est majoritairement ionisé sous sa forme d’urate (UrH2–).
C’est un puissant piégeur de radicaux •OH, ROO• et NOO• en produisant le radical UrH·– , qui est relativement stable en raison de la délocalisation des électrons dans le noyau purine.
L’ion urate peut être ensuite régénéré suite à la réduction du radical UrH·– par l’ascorbate (AscH–, ce qui limite ainsi l’action du radical urate avec d’autres cibles.
Les antioxydants non enzymatiques exogènes
La principale source d’approvisionnement de l’organisme en
antioxydants exogènes sont les aliments soit d’origine animale, soit d’origine végétale. Les plus connus sont la vitamine E , la vitamine C et les polyphénols.
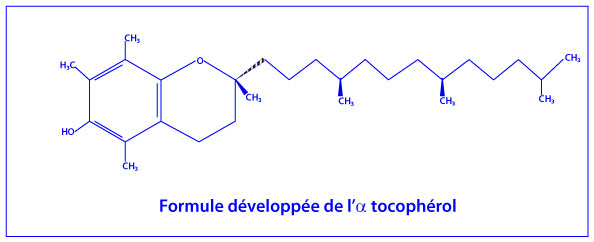
La vitamine E
La vitamine E est un antioxydant liposoluble désignant un ensemble de 8 molécules organiques, 4 tocophérols et 4 tocotriénols, la forme la plus active étant l’alpha-tocophérol et celle la plus abondante dans l’alimentation étant le gamma-tocophérol.
La vitamine E s’incorpore facilement dans les membranes cellulaires et les protège contre la peroxydation lipidique en neutralisant les radicaux peroxyle, alkyle et alcoxyle (ROO•). L’αlpha-tocophérol est la forme la plus active de la vitamine E. Elle réagit directement sur les peroxydes ce qui conduit à son oxydation en radical tocophéryle. La vitamine C et/ou le glutathion réagissent en synergie avec la vitamine E permettant ainsi sa régénération par la réduction du radical tocophéryl. In vitro, les vitamines E et C augmentent l’activité de la gluthathion peroxidase, de la superoxyde dismutase et de la glutathion réductase, et elles diminuent la peroxydation lipidique. (Vitamine E Wikipedia)
])
La vitamine C
La vitamine C ou acide L-ascorbique (AscH) est un antioxydant hydrosoluble, présent sous sa forme ascorbate anionique (AscH-) au pH physiologique. Elle est capable de réagir directement sur les DROs et en particulier avec les ions superoxydes O2•- . Comme la vitamine E, elle limite la peroxydation lipidique en piégeant les radicaux peroxyle. Enfin, elle assure la régénération de la vitamine E par réduction spontanée du radical tocophéryl. (Vitamine C Wikipedia)
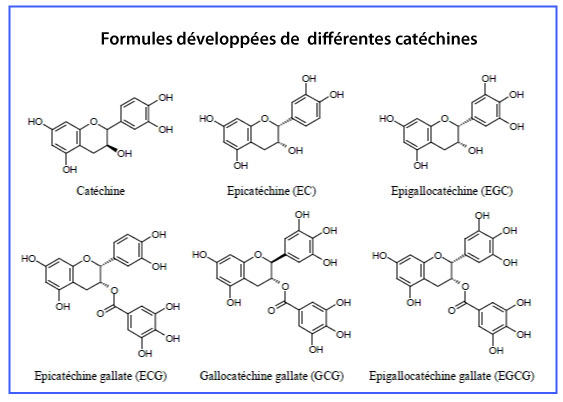
Les catéchines
Les catéchines sont des molécules polyphénoliques hydrosolubles, composées d’au moins un groupement phénolique.
Elles sont abondantes dans certaines plantes, particulièrement dans les feuilles de thé et dans le vin. Elles ont la capacité de piéger les ions superoxydes O2•- , et l’oxygène singulet 1O2, O2•- étant directement réduit en H2O2.
Articles
Le stress oxydant cutané
L’EPIDERME, UNE BARRIERE SUR TOUS LES FRONTS
Mots-clés dans le même groupe
Autres groupes de mots-clés
Site réalisé avec SPIP 3.0.17 + AHUNTSIC
Visiteurs connectés : 46