Poster un message
En réponse à :
Le stress oxydant cutané
<
Rappels
La stabilité d’un composé chimique est dépendante de l’organisation de sa couche électronique externe ; un composé est stable lorsque les électrons sont appariés deux à deux.
Un radical libre peut être défini par une espèce chimique possédant un ou plusieurs électrons libres non appariés sur sa couche externe. Du fait de la présence d’un électron célibataire, les radicaux libres présentent une grande instabilité, ont une durée de vie courte et sont capables de réagir avec de nombreux composés.
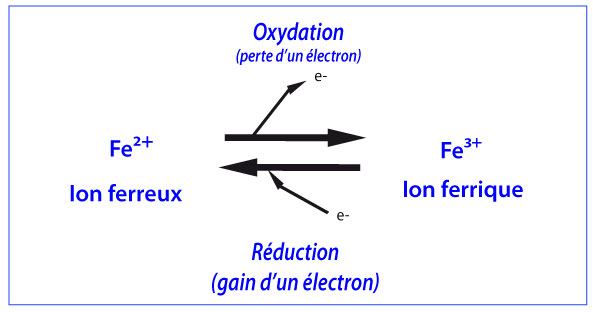
L’oxydation d’un composé correspond à la perte d’un électron et la réduction au gain d’un électron. Par exemple :
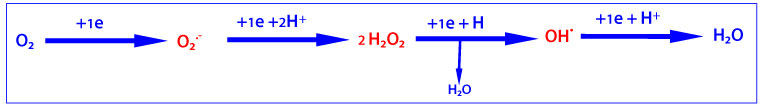
L’atome d’oxygène a 6 électrons sur sa couche externe, présente deux électrons non appariés, a une faible réactivité mais peut générer des dérivés plus réactifs, par des réductions univalentes séquentielles comme indiqué ci dessous :
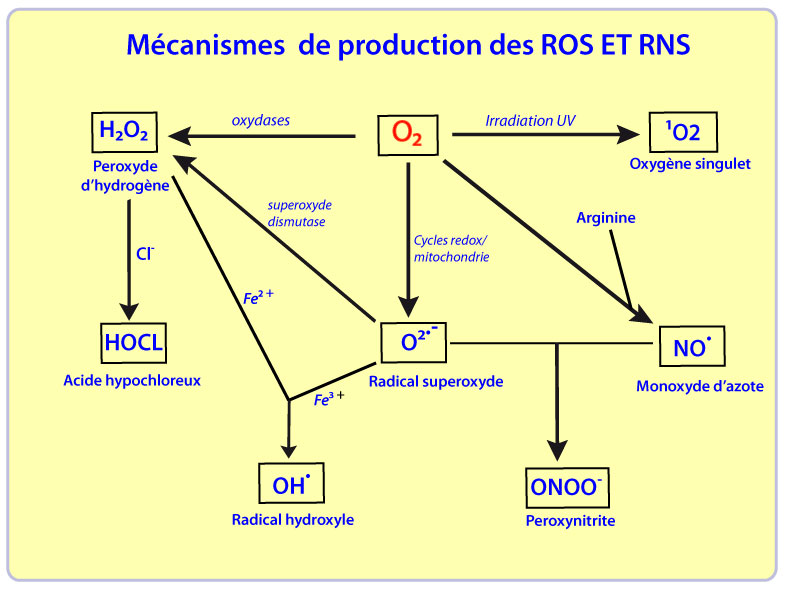
Dans le cas d’un apport énergétique suffisant, l’oxygène moléculaire peut capturer un électron supplémentaire pour donner l’anion superoxyde (O2•- ). Ce radical libre, en se combinant avec deux ions hydrogène (H+), peut générer du peroxyde d’oxygène (H2O2). Au contact d’ions ferreux présents dans la cellule, le peroxyde d’hydrogène peut donner deux radicaux hydroxyles (•OH).
Les espèces réactives de l’oxygène (DROs)
Les DROs comprennent l’oxygène singulet (1O2), l’anion superoxyde (O2.- ), le radical hydroxyle (•OH), le peroxyde d’hydrogène (H2O2), et l’ozone (O3). Selon les auteurs, ils incluent également le monoxyde d’azote (NO•), l’anion peroxynitrite (ONOO-), également désignés espèces réactives de l’azote, et les radicaux peroxyles (RO• et ROO•).
L’oxygène singulet (1O2) est la forme « excitée » de l’oxygène moléculaire qui est très instable et extrêmement réactif, et a une durée de vie est très limitée. Au contact des molécules de son environnement, notamment les molécules d’eau, il se désactive en libérant de l’énergie. Il est formé en moindre quantité que les oxy-radicaux et est produit lors de la peroxydation lipidique , la flambée respiratoire et suite à l’action des rayons ultraviolets sur le dioxygène.
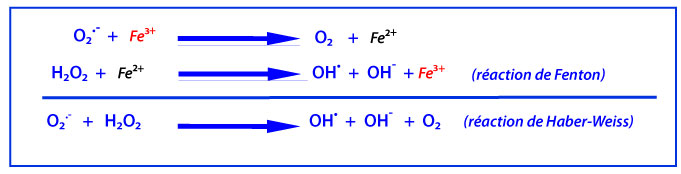
A l’inverse, les anions superoxydes (O2•- ) sont formés par la capture d’un électron par la molécule d’oxygène. Ils ont une faible réactivité avec les composés biologiques et ne réagissent ni avec les acides nucléiques et leurs constituants, ni avec les protéines et leurs acides aminés, ni avec les lipides et leurs acides gras. Par contre, ils ont une demi-vie relativement longue (supérieure à quelques dizaines de secondes) ; ils peuvent donc diffuser vers leurs cibles, en particulier les superoxyde dismutases, les ions Fe2+, ou encore la vitamine C . Toutefois, la présence de la charge électrique nègative sur cette molécule bloque leur diffusion au travers des membranes biologiques. En fait, ils sont indirectement toxiques en réagissant avec le peroxyde d’hydrogène (H2O2) et le monoxyde d’azote (NO), produisant respectivement des radicaux hydroxyles ((•OH) et des peroxynitrites (ONOO-). Inversement la dismutation spontanée des anions superoxydes aboutit à la formation de peroxyde d’hydrogène selon la réaction de Haber-Weiss (voir ci-dessous).
Les radicaux hydroxyles (•OH) sont les radicaux les plus délétères. Ils présentent une extrême réactivité, une demi-vie limitée (10-10 s dans les systèmes biologiques), diffusent donc peu et sont les plus toxiques lors d’un stress oxydant . Ils agissent selon trois mécanismes : en arrachant soit un électron soit un atome d’hydrogène ou encore en s’additionnant sur les doubles liaisons. Leur cibles biologiques sont la plupart des molécules organiques et inorganiques des cellules, en particulier, l’ADN, les protéines, les lipides, les acide-aminés, les sucres et les métaux. Le radical •OH est produit au sein des cellules,suite soit à la réaction de Haber-Weiss, soit à la réaction de Fenton qui nécessite des catalyseurs métalliques (voir figure ci-dessous).
La significativité de la réaction de Fenton dans les conditions physiologiques n’est pas claire car les ions fer sous la forme libre catalyseur sont peu disponibles en raison de leur séquestration par une variété de protéines piégeuses de métaux.
Le peroxyde d’hydrogène (H2O2), également appelée dioxyde de dihydrogène ou « eau oxygénée » est très soluble dans l’eau, pénètre facilement les membranes biologiques, et peut provoquer la dégradation des protéines, la libération de Fe3+, l’oxydation de l’ADN, de lipides, ou encore de thiols, mais également l’inactivation d’enzymes. Sa capacité à traverser les membranes biologiques et à diffuser loin de son lieu de synthèse, fait du peroxyde d’hydrogène une des composantes utilisée par les cellules dans la signalisation intra et/ou intercellulaire. En effet, en faible concentration, il ne présente pas de toxicité pour la cellule. Cependant, en forte concentration, il induit une cytotoxicité par le biais des DROs qu’il génère. En se décomposant en anions hydroxyles et en radicaux hydroxyles par la réaction de Fenton en présence de sels métalliques (Fe2+ et Cu+), il devient toxique.
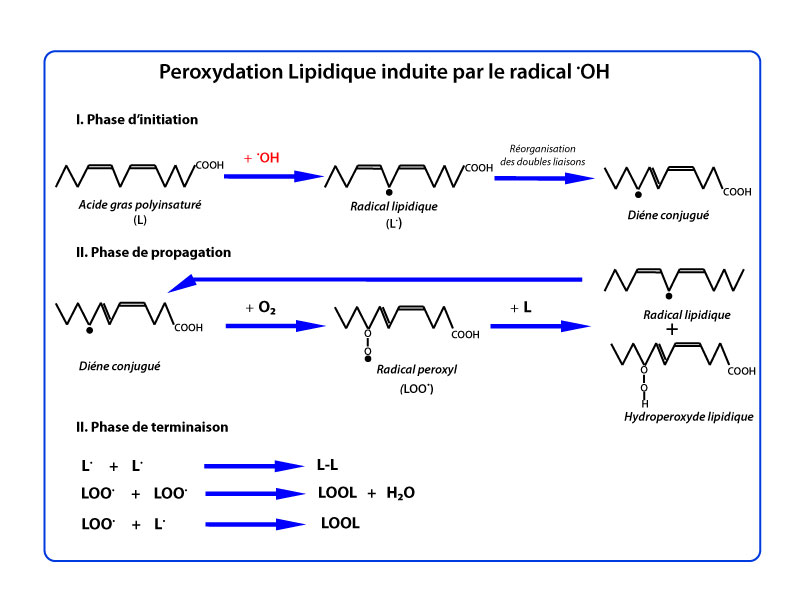
Les radicaux peroxyles (ROO•- ) sont des radicaux secondaires issus de l’oxydation de substrats organiques, initiée par l’oxygène singulet ou le radical hydroxyle (•OH). Ils sont dotés d’un pouvoir oxydant important mais inférieur à celui de (•OH), avec le même mécanisme d’action que ce dernier. Ils peuvent également se décomposer pour donner des radicaux superoxyde (O2•- ). Ils sont à l’origine de réactions en chaine et la peroxydation des lipides est un exemple d’oxydation très dangereux pour les cellules avec des conséquences multiples en induisant une diminution de la fluidité des membranes plasmiques et une augmentation de la charge négative de surface, et en perturbant les membranes des organites cellulaires. On observe ainsi une inactivation des enzymes membranaires, une oxydation des groupements thiols, une augmentation de la perméabilité membranaire, un gonflement des mitochondries avec inhibition de la chaine respiratoire et la perte du cytochrome C.
Le monoxyde d’azote (NO•) est issu de l’oxydation de l’un des azotes terminaux de l’acide aminé L-Arginine. NO• peut réagir avec une grande variété de substances et de radicaux libres et conduire, par exemple après réaction avec (H2O2), à la formation de nitrite (NO2-) ou de nitrate (NO3-).
Le peroxynitrite (ONOO-) est formé suite à la réaction entre O2•- et NO• avec une constante de vitesse de 6,7.109 L.mol-1.s-1. La forme protonée du radical peroxynitrite (ONOOH) est un puissant agent oxydant causant des dommages importants similaires à ceux observés avec •OH.
Les sources endogènes de DROs
Les dérivés réactifs de l’oxygène (DROs), sont essentiellement d’origine enzymatique et découlent de plusieurs sources ; ils sont produits :
- dans des conditions physiologiques normales, au sein des cellules :
- par la chaine respiratoire
- lors d’activités enzymatiques, telles que celle de la NADPH oxydase
- par des monoxygénases à fonction mixtes
- par les peroxysomes
- au cours des réactions de défense dans les cellules phagocytaires :
- par le système de la NADPH oxydase
- par la myeloperoxidase
- par la NO synthase inductible
La chaine respiratoire des mitochondries
Les dérivés réactifs de l’oxygène (DROs), sont notamment issus des réactions d’oxydo-réductions enzymatiques le long de la chaîne de transfert des électrons, au sein des mitochondries. Celles-ci sont responsables de la production de l’énergie indispensable au travail cellulaire et sont donc considérées comme les « centrales énergétiques » de la cellule. En effet, notre organisme utilise l’oxygène pour transformer l’énergie qui provient de l’alimentation en une forme utilisable pour nos cellules, l’ATP et c’est au niveau de la chaîne respiratoire des mitochondries que s’effectue la réduction de l’oxygène en eau, avec la formation de 6 molécules d’adénosine triphosphate (ATP), molécules à haut potentiel énergétique, pour une molécule de dioxygène réduite.
Les DROs résultent d’une réduction incomplète du dioxygène en O2•- au niveau du cytochrome b et de la NADH déshydrogénase où 2 à 5 % de l’oxygène consommé sont ainsi converti en DROs. Cette production de DROs par les mitochondries est un processus continu et physiologique, qui compte tenu de l’activité intense et constante des mitochondries, représente la source majeure de DROs au sein des organismes vivants.
La NADPH oxydase
La NAD(P)H oxydase est une enzyme localisée au niveau de la membrane cytoplasmique et, chez les phagocytes, également dans la membrane du phagosome (membrane formée pendant la phagocytose à partir de la membrane plasmique) et dans la membrane des granules azurophiles des neutrophiles.
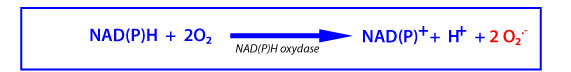
La NADPH utilise le NADH ou le NADPH intracellulaire comme donneur d’électrons pour catalyser la réduction monoélectronique de l’oxygène en O2•- , selon la réaction :
Les NAD(P)H oxydases des cellules non phagocytaires ont une activité de 10 à 100 fois moins élevée que celle des cellules phagocytaires et les DROs qu’elles produisent jouent un rôle dans la signalisation intracellulaire.
Les autres sources de DROs au sein de l’organisme résultent de l’activité de la NAD(P)H oxydase membranaire au sein des cellules phagocytaires ou de la xanthine oxydase présente dans le foie et le sang.
La Xanthine oxydase
Il existe deux types de xanthine oxydase interconvertibles également connus sous le nom de xanthine oxydoréductase (XOR) qui différent par leur forme et par leur mode d’action. Elles peuvent être soit de type xanthine oxydase (XO), dépendantes de l’O2, soit de type xanthine déshydrogénase (XD), dépendantes du NAD+.
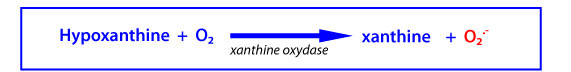
XO est une enzyme cytosolique qui catalyse l’oxydation de l’hypoxanthine en xanthine et la réduction de O2 en O2•- selon la réaction :
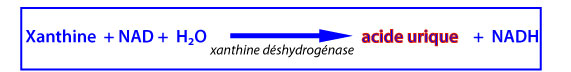
La xanthine est ensuite oxydée par XDR en acide urique selon la réaction :
L’activité de XO génère donc de l’O2•- à l’origine d’autres DROs et DRNs et celle de XD est source d’acide urique réputé être un piégeur puissant des radicaux libres. ’interconvertibilité XO/XD fait de ce système enzymatique un important régulateur du potentiel redox cellulaire.
Dans le cas de l’ischémie, la grande consommation de l’ATP conduit à une accumulation d’hypoxanthine et de xanthine, des catabolites de la purine ; la XD se convertit en XO qui en utilisant l’O2 oxyde ces derniers, ce qui entraîne une production accrue de O2•- et de H2O2.
Les peroxysomes
Les peroxysomes sont des organites cellulaires délimités par une seule membrane, présents dans toutes les cellules et sont les seuls organites cellulaires avec les mitochondries et les réticulums endoplasmiques à consommer de l’oxygène lors du métabolisme.
Dans les conditions physiologiques, les peroxysomes sont connus par le fait qu’en présence d’une large variété d’enzymes peroxysomales regroupées sous le nom d’oxydases, ils synthétisent H2O2, lors de la réduction de l’oxygène moléculaire en eau et ne produisent pas de O2·–. La respiration peroxysomale n’étant pas couplée à la phosphorylation oxydative, elle ne permet pas la production de l’ATP et l’énergie libre résultante des réactions d’oxydoréduction est libérée sous forme de chaleur. La β-oxydation des acides gras et les réactions enzymatiques des oxydases comptent parmi les principaux processus métaboliques impliqués dans la génération de H2O2 dans les peroxysomes.Les peroxysomes génèrent H2O2 principalement par la β-oxydation des acides gras et l’activité enzymatique des oxydases.
Les cellules phagocytaires
Le système immunitaire a la capacité d’identifier les corps étrangers à l’organisme ou les cellules altérées et à mettre en place rapidement des mécanismes de défense appropriés assurant leur éradication. Parmi les composants du système immunitaire, les cellules phagocytaires sont les premiers leucocytes recrutés en cas d’invasion par un agent pathogène. En particulier, les granulocytes neutrophiles qui représentent 50 à 70 % des globules blancs sont les premiers à entrer massivement dans les tissus infectés pour y résider. Ceux sont de redoutables phagocytes et leur granules contiennent de nombreuses enzymes et molécules antimicrobiennes qui déversées dans les vésicules de phagocytose vont détruire les micro-organismes phagocytés.
Durant la phagocytose des microbes, les neutrophiles augmentent leur consommation en oxygène moléculaire suite à l’activation de la NADPH oxydase membranaire. On parle d’une « flambée respiratoire » dont la fonction physiologique est la destruction des pathogènes intrus. L’anion superoxyde est le premier dérivé de l’oxygène formé et sert ensuite de précurseur pour la formation d’autres métabolites dérivés de l’oxygène.
En présence des halogènes tels que Cl-, la myéloperoxydase qui est le composé majoritaire des granules azurophiles des neutrophiles catalyse la conversion de H2O2en acides fortement toxiques tels que l’acide hypochloreux HOCl qui pourra ensuite réagir avec les amines ou H2O2 pour former respectivement les chloramines (RNH2Cl) ou l’oxygène singulet (1O2).
La NO synthase inductible se trouve dans les macrophages en concentration faible dans des conditions normales. Par contre, lors d’une agression de l’organisme par un agent pathogène, son expression peut être considérablement augmentée. Le NO• produit sert alors à la fois de médiateur pour la réponse immunitaire mais également joue un rôle majeur comme molécule antibactérienne.
Les oxydants, ainsi produits par les cellules phagocytaires, ont une large gamme de cibles en l’occurrence tous les genres de bactéries, certaines moisissures, certains parasites unicellulaires (leishmania, toxoplasme) et certains métazoaires (stades larvaires de schistosomes).
Les sources exogènes de DROs
Les sources exogènes sont majoritairement des pro-oxydants environnementaux tels que les pesticides, les métaux lourds, la fumée de cigarettes, les polluants, la poussière (d’amiante, de silice), et les composés induits par la prise de certains médicaments, par le rayonnement électromagnétique (radiation ionisante, lumière ultraviolette), ou lors d’un coup de chaleur .
Les systèmes anti-oxydants
Les systèmes de défense de l’organisme contre l’activité des DROs sont multiples et complexes et comprennent soit des systèmes de prévention qui empêchent la formation des DROs soit des systèmes de réparation ou d’élimination des cibles biologiques endommagées par les DROs.
Les principaux mécanismes impliqués dans la prévention de l’activité des anti -oxydants sont :
- de transformer les DROs en espèces moins toxiques
- d’empêcher l’interaction entre espèces chimiques
- de prévenir ou réparer les lésions induites par les DROs
Ces systèmes peuvent être soit enzymatiques, soit moléculaires. Ils peuvent être d’origine endogènes ou exogènes et peuvent être des composés naturels ou synthétiques.
Les systèmes enzymatiques anti-oxydants
Les superoxydes dismutases
Les superoxydes dismutases (SOD) sont des métalloprotéines responsable de la dismutation spontanée du radical superoxyde en peroxyde d’hydrogène selon la réaction suivante :
Elles sont de trois types :
-* une SOD à cuivre et à zinc (Cu,Zn-SOD), intracellulaire, située dans le cytoplasme et dans l’espace intermembranaire des mitochondries ; elle remplit une action antioxydante importante dans l’espace intermembranaire mitochondrial où il y a une accumulation importante de protons. En effet, les O2•- entrants dans cet espace seront immédiatement dismutés par la Cu,Zn-SOD afin d’éviter la formation des radicaux plus réactifs, les HO2·. Cette action antioxydante évite l’oxydation des acides gras polyinsaturés, et par conséquent protège des réactions en chaîne dans cette partie cellulaire riche en lipides
insaturés.
-* une autre SOD à cuivre et à zinc est extracellulaire principalement dans la matrice extracellulaire des tissus et à un degré moindre dans les liquides extracellulaires des tissus (plasma, lymphe) ; elle joue un rôle important dans la protection des surfaces cellulaires et des protéines de la matrice extracellulaire contre l’action des O2•- ,
-* une SOD à manganèse (Mn-SOD) qui est située à la fois dans la matrice et au niveau de la membrane interne de la mitochondrie.
-* Le peroxyde d’hydrogène formé peut être à son tour éliminé par deux autres enzymes : la catalase et la gluthathion peroxydase . ([superoxyde dismutase wikipedia-<http://fr.wikipedia.org/wiki/Superoxyde_dismutase])
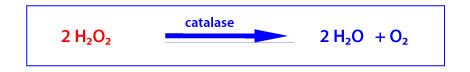
La catalase
La catalase est une enzyme héminique composée de quatre chaînes polypeptidiques. Son site catalytique permet l’élimination du peroxyde d’hydrogène, présent à haute concentration, selon la réaction globale suivante (k = 2.107 L.mol-1.s-1) :
Quatre molécules de NADPH, liées à la catalase, confèrent à cette enzyme une protection contre l’attaque de H2O2 ou comme source de NADPH pour la glutathion peroxydase. Son activité est particulièrement abondante dans les globules rouges, le foie et les reins. La catalase joue un rôle important dans la détoxication de H2O2 dans les peroxysomes.
La gluthathion peroxydase
La gluthathion peroxydase est une enzyme dépendante du sélénium qui a une forte affinité pour le peroxyde d’hydrogène ; elle permet donc l’élimination du peroxyde d’hydrogène, même présent à faible concentration, selon la réaction suivante :
Le maintien de l’activité de la GPx nécessite la régénération du gluthathion (GSH ) assurée par la glutathion réductase selon la réaction :
Les antioxydants non enzymatiques endogènes
Ils existent de nombreux réducteurs endogènes participant à la protection de l’organisme contre les DROs, les plus importants étant le gluthathion, la bilirubine, l’acide urique, le coenzyme Q, les oestrogènes, la mélanine , la mélatonine et l’acide lipoique.
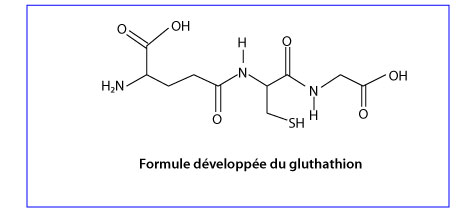
Le gluthation
Le gluthathion (GSH) est un tripeptide composé de trois acides aminés : l’acide L-Glutamique, la LCystéine et la L-Glycine.
Le site principal de la synthèse du GSH au niveau cellulaire est le cytosol, à partir duquel il est distribué aux autres compartiments cellulaires. Le GSH est synthétisé par l’action séquentielle de la glutamate-cystéine ligase et la glutathion synthétase.
Il est présent en grande quantité dans les organes exposés aux toxines tels que les reins, le foie, les poumons ou les intestins et peu présent dans les fluides biologiques. Le GSH joue un rôle primordial dans les cellules où il participe à la synthèse des protéines et de l’ADN, au transport des acides aminés et plus généralement à la détoxification cellulaire. Enfin, le GSH permet la réduction du peroxyde d’hydrogène en eau selon une réaction catalysée par la glutathion peroxydase.
Dans les tissus et le plasma, le GSH se trouve sous différentes formes :
- forme réduite dite aussi forme thiol (GSH),
- forme oxydée dite aussi forme disulfure qui est due à la liaison de 2 GSH par un pont disulfure
- et des formes mixtes appelées aussi disulfures mixtes (GSSR) produites suite à l’interaction du GSH avec d’autres thiols.
GSH est le thiol intracellulaire majoritaire. Dans les conditions physiologiques normales, il est présent essentiellement sous sa forme réduite. La mesure du taux GSH/GSSG est une bonne méthode pour évaluer le stress oxydant dans l’organisme.
Le potentiel antioxydant du gluthathion est du à son habilité à donner l’hydrogène ce qui lui permet de réduire les radicaux libres, et certaines espèces réactives telles que HOCl et ONOO–. GSH est aussi capable de chélater les ions cuivreux et ferreux, ce qui inhibe la réaction de Fenton. In vivo, GSH constitue ainsi la première ligne de défense contre la toxicité des métaux.(guthathion wikipedia)
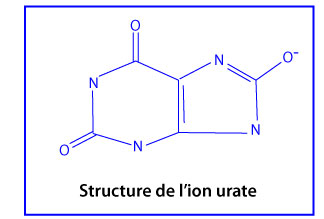
L’acide urique
L’acide urique est formé suite à l’oxydation de l’hypoxanthine et de la xanthine par la xanthine oxydase (voir ci-dessus). réducteur. Dans les conditions physiologiques, l’acide urique est majoritairement ionisé sous sa forme d’urate (UrH2–).
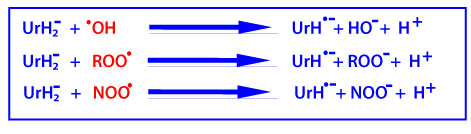
C’est un puissant piégeur de radicaux •OH, ROO• et NOO• en produisant le radical UrH·– , qui est relativement stable en raison de la délocalisation des électrons dans le noyau purine.
L’ion urate peut être ensuite régénéré suite à la réduction du radical UrH·– par l’ascorbate (AscH–, ce qui limite ainsi l’action du radical urate avec d’autres cibles.
Les antioxydants non enzymatiques exogènes
La principale source d’approvisionnement de l’organisme en
antioxydants exogènes sont les aliments soit d’origine animale, soit d’origine végétale. Les plus connus sont la vitamine E , la vitamine C et les polyphénols.
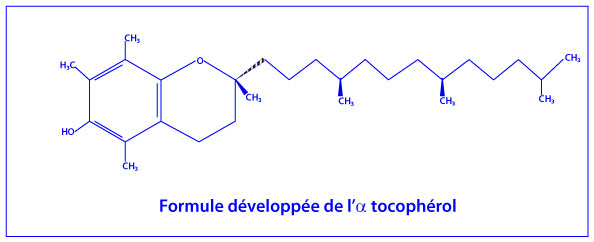
La vitamine E
La vitamine E est un antioxydant liposoluble désignant un ensemble de 8 molécules organiques, 4 tocophérols et 4 tocotriénols, la forme la plus active étant l’alpha-tocophérol et celle la plus abondante dans l’alimentation étant le gamma-tocophérol.
La vitamine E s’incorpore facilement dans les membranes cellulaires et les protège contre la peroxydation lipidique en neutralisant les radicaux peroxyle, alkyle et alcoxyle (ROO•). L’αlpha-tocophérol est la forme la plus active de la vitamine E. Elle réagit directement sur les peroxydes ce qui conduit à son oxydation en radical tocophéryle. La vitamine C et/ou le glutathion réagissent en synergie avec la vitamine E permettant ainsi sa régénération par la réduction du radical tocophéryl. In vitro, les vitamines E et C augmentent l’activité de la gluthathion peroxidase, de la superoxyde dismutase et de la glutathion réductase, et elles diminuent la peroxydation lipidique. (Vitamine E Wikipedia)
])
La vitamine C
La vitamine C ou acide L-ascorbique (AscH) est un antioxydant hydrosoluble, présent sous sa forme ascorbate anionique (AscH-) au pH physiologique. Elle est capable de réagir directement sur les DROs et en particulier avec les ions superoxydes O2•- . Comme la vitamine E, elle limite la peroxydation lipidique en piégeant les radicaux peroxyle. Enfin, elle assure la régénération de la vitamine E par réduction spontanée du radical tocophéryl. (Vitamine C Wikipedia)
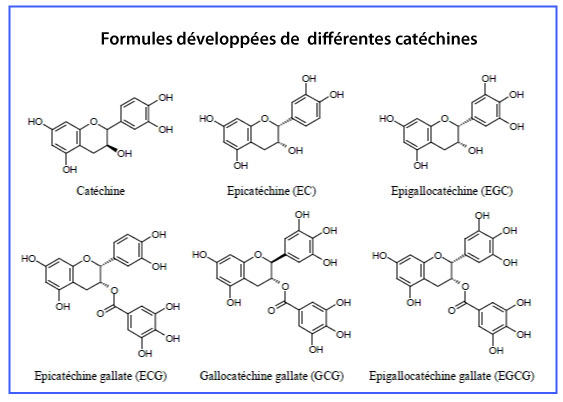
Les catéchines
Les catéchines sont des molécules polyphénoliques hydrosolubles, composées d’au moins un groupement phénolique.
Elles sont abondantes dans certaines plantes, particulièrement dans les feuilles de thé et dans le vin. Elles ont la capacité de piéger les ions superoxydes O2•- , et l’oxygène singulet 1O2, O2•- étant directement réduit en H2O2.
Bibliographie
Site réalisé avec SPIP 3.0.17 + AHUNTSIC
Visiteurs connectés : 49