Poster un message
En réponse à :
La cellule de Langerhans
Décrites par Paul Langerhans en 1868, les cellules de Langerhans sont des cellules dendritiques qui ont un aspect clair dans des coupes histologiques en paraffine (#Langerhans, 1868). Chez l’homme, elles constituent 2 à 4 % de la population cellulaire épidermique. Elles sont rares dans la couche basale et sont situées préférentiellement en position suprabasale dans l’épiderme ; elles émettent de fins prolongements cellulaires entre les kératinocytes avec lesquels elles sont en contact étroit par l’intermédiaire d’une liaison homophile entre deux molécules de E-cadhérine, présentes sur chacun des deux types de cellule.
1. Morphologie des cellules de Langerhans
En microscopie électronique à transmission, la cellule de Langerhans est identifiable par son cytoplasme clair sans tonofilaments, ni mélanosomes , un noyau bilobé avec des circonvolutions, l’absence de desmosomes , et surtout la présence d’organites caractéristiques en forme de raquette ou de batonnet, les granules de Birbeck. Ces derniers sont constitués de deux membranes accolées, séparées par une zone régulièrement striée en « fermeture Eclair » (#Birbeck et al., 1961) (voir figure ci-dessous).
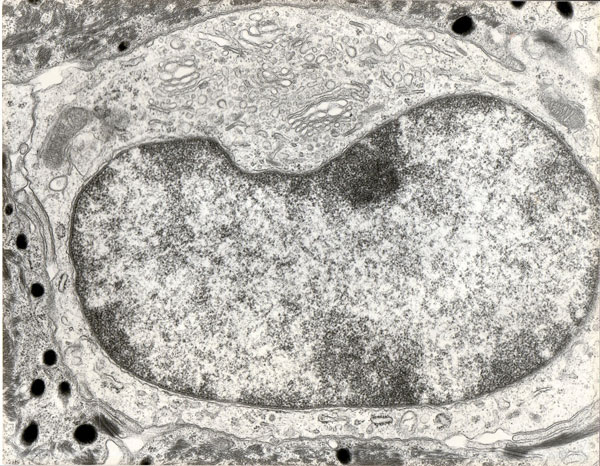
- Une cellule de Langerhans observée en microscopie électronique à transmission dans une peau humaine transplantée sur la souris nude, deux mois après la greffe (x 10000).
- Noter la présence de granules de Birbeck et l’absence de desmosomes avec les kératinocytes voisins.
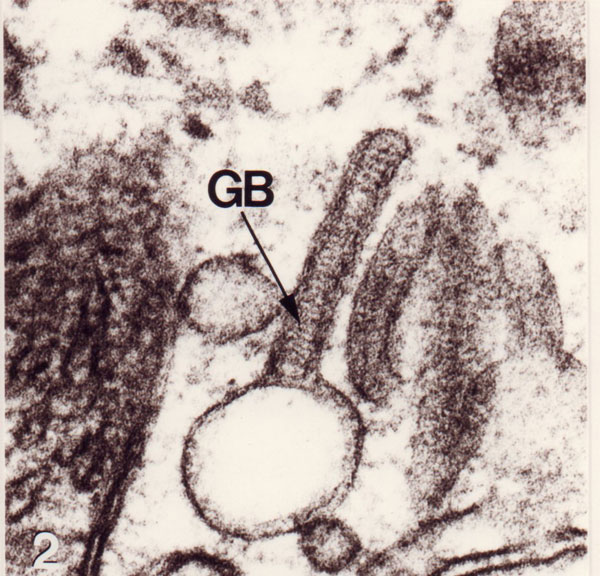
- Détail d’un granule de Birbeck dans une cellule de Langerhans humaine observée en microscopie électronique à transmission (x 100000).
Elles peuvent être mises en évidence par une réaction immunohistochimique qui révèle l’activité de l’adénosine triphosphatase. Par les techniques d’immunohistochimie, les cellules de Langerhans humaines peuvent être marquées avec des anticorps dirigés contre la molécule CD1a, une molécule du complexe majeur d’histocompatibilité de type I qui présente les lipides microbiens aux cellules T et plus récemment, avec un anticorps dirigé contre la langerine (CD207), spécifique des granules de Birbeck, une lectine membranaire de type C qui reconnait des ligands mannosylés situés à la surface d’un grand nombre de pathogènes comprenant des virus, des bactéries, des champignons et des protozoaires.
Les cellules de Langerhans expriment également le marqueur CD45 des leucocytes ainsi que les marqueurs propres aux lignées hématopoïétiques myéloïdes, tels CD33 et CD13. Elles expriment également des molécules d’adhérence, telle l’E-cadhérine, qui leur permet une adhérence homotypique avec les kératinocytes. Enfin, les cellules de Langerhans possèdent tous les composants de la machinerie de présentation antigénique, molécules du complexe majeur d’histocompatibilité (CMH) de classe I et II et chaîne invariante Ii/CD74.
2. D’où proviennent les cellules de Langerhans
2.1 L’origine des cellules de Langerhans humaines
Dans un premier temps, des expériences de greffe de moelle osseuse allogénique réalisées chez la souris ont montré que les cellules de Langerhans dérivent des cellules souches hématopoïétiques situées dans la moelle osseuse (#Katz et al., 1979). Dans ces expériences, des souris sont exposées à des rayonnements X très intenses qui induisent, chez ces animaux, la destruction des cellules souches de la moelle osseuse. Une greffe de moelle osseuse de souris allogénique à une souris irradiée aboutit à l’apparition de cellules de Langerhans du donneur dans l’épiderme de cette souris. Ces expériences semblaient donc indiquer que les cellules de Langerhans représentent une population de cellules en transit dans l’épiderme et qui sont constamment renouvelées à partir de cellules souches de la moelle osseuse.
Dans un deuxième temps, des expériences réalisées avec le modèle de peau humaine greffée sur la souris nude, apportèrent un nouvel éclairage sur l’origine et la circulation des cellules de Langerhans dans un état stable (#Démarchez et al., 1993). Dans ce système, en accord avec les travaux de Krueger et al. et en utilisant des techniques d’histochimie, de microscopie électronique, et d’immunohistologie, nous avons pu montrer que les cellules de Langerhans humaines se maintiennent dans la peau greffée. Bien que le nombre de cellules de Langerhans diminue dans les premières semaines après la greffe, il redevient pratiquement normal, un mois après la greffe et reste stable ensuite. De plus, nous avons pu également montré que quand une plaie est créée au centre de la peau humaine transplantée, des cellules de Langerhans humaines provenant de l’épiderme humain non lésé repeuple l’épiderme cicatriciel.
Pour étudier si des cellules de Langerhans de souris repeupleraient un épiderme humain greffé dépourvu de cellules de Langerhans humaines, nous avons greffé sur la souris nude, deux types différents d’équivalents de peau humaine reconstruite in vitro. Ils étaient composés de kératinocytes humains déposés soit sur un derme désépidermisé, soit sur un lattis constitué de fibroblastes inclus dans du collagène de type I. Comme attendu, aucune cellule de Langerhans humaine n’a été observée dans le greffon avant ou après la transplantation. Par contre, nous avons observé, à la fois par immunofluorescence indirecte et en microscopie électronique à transmission, des cellules de Langerhans de souris dans l’épiderme humain des deux types d’équivalents de peau reconstruite in vitro. En fait, il est apparu que, à des longues périodes (5 et 12 mois) après la tranplantation de la peau humaine normale sur la souris nude, des cellules de Langerhans des deux origines, humaine et murine étaient présentes dans l’épiderme humain transplanté.
Dans la peau humaine transplantée sur la souris « nude », nous nous trouvions donc dans une situation opposée de celle des expériences de S. Katz, puisque la population de cellules de Langerhans semblait se maintenir en l’absence de renouvellement à partir d’une source externe à la peau greffée. De plus, il était connu, grâce à des expériences faites par J Czerniewlevski et al. que les cellules de Langerhans isolées à partir d’épiderme humain se trouvent à différentes phases du cycle cellulaire. Il semblait donc intéressant d’étudier si les cellules de Langerhans étaient capables de proliférer au sein de l’épiderme.
2.2 Le potentiel prolifératif des cellules de Langerhans dans la peau humaine
Nous avons, en premier lieu, cherché à savoir si les cellules de Langerhans de la peau transplantée synthétisent de l’ADN. Pour cela, nous avons injecté à des souris porteuses de greffon de peau humaine, de la bromodeoxyuridine (BrdU) qui est un analogue de la thymidine et qui s’incorpore à sa place dans l’ADN des cellules en phase de synthèse. Puis, pour détecter les cellules qui ont fabriqué de l’ADN après l’injection, nous avons utilisé un anticorps monoclonal anti-BrdU couplé à la fluorescéine. Mais, comme nous nous intéressions uniquement aux cellules de Langerhans et que d’autres cellules, en particulier les kératinocytes synthétisaient également de l’ADN, nous avons réalisé un double marquage avec OKT6 pour repérer les cellules de Langerhans et l’anti-BrdU pour détecter celle qui auraient incorporé du BrdU. L’observation d’un certain nombre de cellules de Langerhans contenant du BrdU nous démontra que les cellules de Langerhans de la peau humaine transplantée synthétisent de l’ADN.
Dans une seconde étape, nous avons cherché à savoir si toutes les cellules de Langerhans humaines de l’épiderme greffé synthétisent de l’ADN ou si cette propriété est limitée à une sous-population. Après injection de BrdU à des souris porteuses de greffons de peau humaine, toutes les 6 heures, pendant une longue durée (plus de 17 jours), 94% des cellules de Langerhans avaient incorporé du BrdU. Il est donc probable que la majorité des cellules de Langerhans entrent en phase de synthèse d’ADN dans la peau greffée. En réalisant des injections de BrdU pendant des périodes allant de 6 heures à plus de 17 jours, puis en comptant, à chaque stade, le nombre de cellules de Langerhans ayant incorporé du BrdU, nous avons pu, avec l’aide d’un modèle mathématique, déterminer les paramètres du cycle cellulaire des cellules de langerhans. Nous avons établi que la durée totale du cycle cellulaire d’une cellule de Langerhans est de l’ordre de 392 heures (16.3 jours) et que la durée de la phase S est de 12 heures.
Sachant donc que les cellules de Langerhans sont capables de proliférer dans l’épiderme, nous avons alors cherché à déterminer si cette activité prolifératrice pouvait être modulée par des agents exogènes. Pour répondre à cette question, nous avons traité, de deux manières différentes, des souris greffées : 1) en appliquant sur l’épiderme de la peau tranplantéee, du TPA, un promoteur de tumeur connu pour induire une hyperprolifération ou 2) en faisant une série de « strippings », ce qui consiste à arracher à l’aide d’une bande adhésive la couche externe de l’épiderme. Deux jours après l’un ou l’autre des traitements, nous avons pu constaté une augmentation du nombre de cellules de Langerhans ayant incorporé du BrdU par rapport à celui des peaux témoins non traitées. Cette augmentation était de 100 % après l’application de TPA et de l’ordre de 60% après les « strippings ». Ainsi, les cellules de Langerhans de la peau transplantée apparaissent capables de répondre à des stimulants de type chimique (TPA) ou mécanique ("strippings).
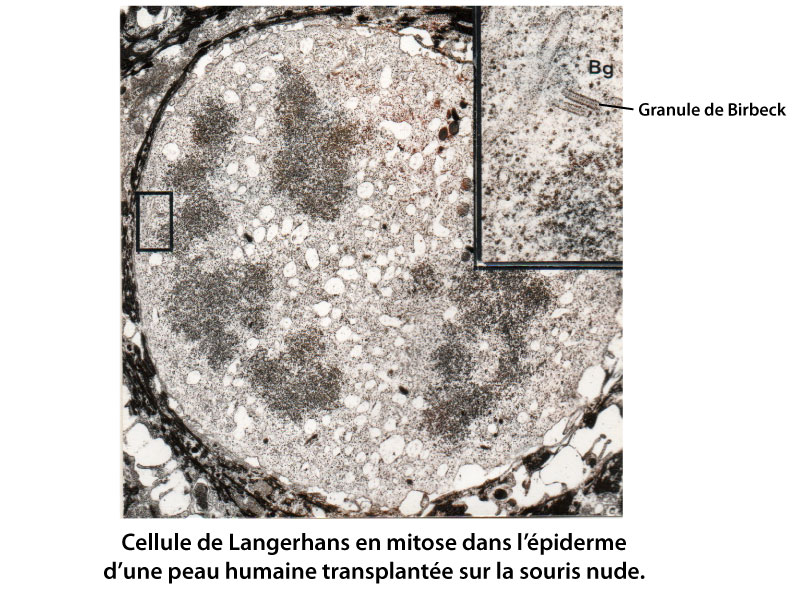
Toutefois, la démonstration que les cellules de Langerhans sont capables de synthétiser de l’ADN dans la greffe n’est pas une preuve absolue de leur capacité de se diviser. Il était également nécessaire de montrer qu’elles entrent en mitose. Comme le marqueur le plus constant des cellules de Langerhans est la présence du granule de Birbeck, nous avons utilisé les techniques de microscopie électronique à transmission pour essayer de voir des cellules de Langerhans en mitose avec des granules de Birbeck. Mais comme les cellules de Langerhans représentent seulement 2 à 3 % des cellules épidermiques et que les cellules en mitoses sont rares, la probabilité de les observer est très faible. Nous avons augmenté nos chances en utilisant des greffons de peau traités au TPA, ce qui devait augmenter le nombre de cellules de Langerhans en mitose. De plus, les souris avaient reçu, 5 heures avant le prélévement des transplants une injection de colchicine, qui bloque les cellules en métaphase. Sur 1000 cellules repérées sur des coupes semi-fines de tissu par leur position suprabasale et leur cytoplasme clair, quatre présentaient des figures de mitose. Observées au microscope électronique à transmission, ces cellules contenaient des granules de Birbeck et présentaient les caractéristiques de cellules en début de métaphase avec la condensation de la chromatine et l’absence de membrane nucléaire et de nucléole (voir figure ci-dessous).
Ainsi, nous avons pu démontré que les cellules de Langerhans de la peau humaine transplantée sur la souris « nude » non seulement se maintiennent après la greffe mais sont également capable de proliférer à l’intérieur de l’épiderme humain et de varier ainsi leur densité en réponse à des stimuli externes. Toutefois, cette conclusion n’est pas incompatible avec le fait que des précurseurs des cellules de Langerhans soient également recrutés en plus, dans la peau dans des conditions qui aboutiraient à une perte exagérée des cellules de Langerhans résidentes.
2.3 Des travaux avec la peau de souris
Plus récemment, des études élégantes de Merad et al. (#Merad et al., 2002) ont confirmé dans la peau de souris ces observations faites avec la peau humaine. Ils ont observé, dans deux modèles expérimentaux indépendants, que des précurseurs de cellules de Langerhans circulants n’entraient pas dans une peau non-inflammatoire. Ainsi, pendant au moins 18 mois après une transplantation de moelle osseuse congénique, la majorité des cellules de Langerhans sont encore issues de l’hôte alors que presque tous les leucocytes circulants, dont les monocytes et les cellules dendritiques, sont issues du donneur, dès 8 semaines après la transplantation.
De plus, il n’y a pas de mélange de cellules de Langerhans chez des souris congénique en parabiose qui ont en commun leur circulation sanguine mais des organes séparés. Par contre, quand la peau est exposée aux UV , les cellules de Langerhans disparaissent rapidement et sont remplacés, en 2 semaines, à partir des précurseurs de cellule de Langerhans en circulation. Le recrutement de nouvelles cellules de Langerhans est apparu dépendre de l’expression à leur surface du récepteur de chimiokine CCR2 et de la production par la peau inflammatoire des chimiokines qui se lient à ce récepteur. Dans des études supplémentaires, quand des souris nouveau-né, ou adulte étaient transplantées avec un foie fétal congénique ou des cellules de moelle osseuse, aucun chimérisme des cellules de Langerhans n’était détecté dans la peau pendant plus de 6 mois, en dépit d’un chimérisme dans la moelle osseuse, la rate et les ganglions lymphatiques.
Ces résultats suggèrent que, dès le premier jour après la naissance, les cellules de Langerhans forment une population autonome dans la peau. Ceci est en accord avec des travaux montrant la présence de cellule de Langerhans différenciées dans l’épiderme de fétus de souris, de rat ou d’homme.
Pour conclure sur l’origine des cellules de Langerhans, il est clair qu’elles sont d’origine hématopoïétique. Toutefois, une fois établies dans la peau, elles forment une population autonome capable de s’auto-renouveler, ne puisant dans les réserves des précurseurs circulants que lors de pertes locales trop importantes pour être compensées par la prolifération du pool local de cellules de Langerhans.
Le mécanisme de régulation qui détermine le nombre de cellules de Langerhans dans l’épiderme humain reste à définir. La cytokine TGFbéta apparaît jouer un rôle clé puisque chez des souris déficientes pour ce gène, les CL sont absentes de la peau. En accord avec cette conclusion, aucune cellule de Langerhans n’est détectée chez des souris déficientes pour le facteur de transcription Id2, lequel est induit par le TGFbéta. Chez l’homme, l’obtention de CL in vitro, à partir de progéniteurs hématopoïétiques CD34+ ou de monocytes, est également strictement dépendante de cette cytokine ; les CL issues de monocytes n’expriment alors plus le marqueur CD14 (#Caux et al., 1992).
3. Fonctions des cellules de Langerhans
Actuellement, il y a un débat sur le rôle physiologique des cellules de Langerhans.
Il a tout d’abord été démontré que les cellules de Langerhans sont des cellules présentatrices d’antigènes qui sont capables de capter des antigènes cutanés, de les appréter et de les transporter de la peau jusqu’aux ganglions lymphatiques régionaux puis de les présenter aux lymphocytes T. L’activation des cellules de Langerhans peut se produire directement par une boucle autocrine (IL-1béta) ou sous l’effet de cytokines produites par les kératinocytes environnants (GM-CSF ou TNFalpha, par exemple). Le déclenchement de l’émigration des cellules de Langerhans serait du à l’induction par certaines de ces cytokines (en particulier, le TNFalpha), d’une diminution de l’expression de la E-cadhérine qui lie la cellule de Langerhans aux kératinocytes environnants.
Ensuite, pour se rendre aux ganglions lymphatiques régionaux, la cellule de Langerhans doit traverser la jonction dermo-épidermique , entrer dans le derme superficiel et pénétrer dans les vaisseaux lymphatiques. Les cellules de Langerhans interagissent avec les éléments de la matrice extracellulaire principalement par l’intermédiaire des intégrines b1 qui permettent les contacts avec la laminine, la fibronectine et les collagènes de type I et IV. Au cours de la migration des cellules de Langerhans, l’expression de CD1a et de la langerine et le nombre de granules de Birbeck diminuent et l’expression des marqueurs d’activation, CD83 et DC-LAMP et de molécules de co-stimulation CD40, CD80 et CD86 augmentent qui interviennent dans le dialogue entre cellule de Langerhans et lymphocytes. Les cellules de Langerhans parvenues dans les vaisseaux lymphatiques sont appelées cellules voilées et sont nommés cellules interdigitées dans les ganglions drainant la peau.
Plus récemment, des travaux utilisant des modèles de souris déficientes en cellules de Langerhans ont mis en question le rôle biologique de cellule présentatrice d’antigène de la cellule de Langerhans puisqu’ils montraient que dans ces souris, l’activation des lymphocytes T par un antigène spécifique appliqué sur la peau était possible, en l’absence des cellules de Langerhans. Toutefois, des résultats inconsistants étaient obtenus dans ces études. cette variabilité pouvaient provenir de beaucoup de facteurs tels que le mode de déplétion des cellules de Langerhans (constitutif ou induit), le site du challenge (épiderme versus épiderme et derme) ; la dose d’antigène, et la chronologie de la procédure d’induction de l’allergie de contact. A ce jour, il n’y a pas eu de protocole utilisant un pathogène strictement épidermotropique tel qu’un papillomavirus.
Très récemment, il est apparu que migration et maturation des cellules de Langerhans ne sont pas toujours liées. Des cellules immatures peuvent migrer jusqu’aux ganglions lymphatiques. Cette observation associée au concept que l’induction d’une réponse immunitaire ou d’une tolérance sont liées à la maturation des cellules de Langerhans et des cellules dendritiques en général, amena à l’hypothèse que les cellules de Langerhans pourraient jouer un rôle dans le développement de la tolérance immune. En effet, cette absence de maturation qui est associée à la non-expression des molécules de co-stimulation et de certaines cytokines telles que l’IL-12 a pour effet une absence de réponse lymphocytaire (anergie) ou une immunosuppression caractérisée par l’expansion de lymphocytes T régulateurs et une production de cytokines immunosuppressives, telles que l’IL-10.
Bibliographie
Pour revue, voir :
La cellule de Langerhans en 2004 par Daniel Schmitt ; Keratin 2005 ; 9 ; 4-12.
Collin M, Milne P. Langerhans cell origin and regulation. Curr Opin Hematol.
2016 Jan ;23(1):28-35.
Cellules dendritiques des muqueuses et de la peau par Marie Le Borgne, Bertrand Dubois, Dominique Kaisernian ; MEDECINE/SCIENCES 2007 ; 25 ; 819-25.
Birbeck MS, Breathnach AS, Everall JD. An electron microscope study of basal melanocytes and high-level clear cells (Langerhans cells ) in vitiligo . J Invest Dermatol 1961 ; 37 : 51-64.
Caux C, Dezutter-Dambuyant C, Schmitt D, Banchereau J. GM-CSF and TNF-alpha cooperate in the generation of dendritic Langerhans cells. Nature 1992 ; 360 : 258-61.
Czernielewski JM, Démarchez M. Further evidence for the self-reproducing capacity of Langerhans cells in human skin. J Invest Dermatol. 1987 Jan ;88(1):17-20.
Démarchez M, Asselineau D, Czernielewski J. Migration of Langerhans cells into human epidermis of « reconstructed » skin, normal skin, or healing skin, after grafting onto the nude mouse .
J Invest Dermatol. 1993 May ;100(5):648-52.
Geissmann F, Prost C, Monnet JP, et al. Transforming growth factor beta1, in the presence of granulocyte/macrophage colony-stimulating factor and interleukin 4, induces differentiation of human peripheral blood monocytes into dendritic Langerhans cells. J Exp Med 1998 ; 187 : 961-6.
Hacker C, Kirsch RD, Ju XS, et al. Transcriptional profiling identifies Id2 function in dendritic cell development. Nat Immunol 2003 ; 4 : 380-6.
Katz SI, Tamaki K, Sachs DH. Epidermal Langerhans cells are derived from cells originating in bone marrow. Nature 1979 ; 282 : 324-6.
Kissenpfennig A, Henri S, Dubois B, et al. Dynamics and function of Langerhans cells in vivo dermal dendritic cells colonize lymph node areas distinct from slower migrating Langerhans cells. Immunity 2005 ; 22 : 643-54.
Langerhans P. Uber die Nerven der menschlichen Haut. Virchows Arch Path Anat 1868 ; 44 : 325-37.
Merad M, Manz MG, Karsunky H, et al. Langerhans cells renew in the skin throughout life under steady-state conditions. Nat Immunol 2002 ; 3 : 1135-41.
Stoitzner P, Pfaller K, Stossel H, Romani N. A close-up view of migrating Langerhans cells in the skin. J Invest Dermatol 2002 ; 118 : 117-25.
Valladeau J, Ravel O, Dezutter-Dambuyant C, et al. Langerin, a novel C-type lectin specific to Langerhans cells, is an endocytic receptor that induces the formation of Birbeck granules. Immunity 2000 ; 12 : 71-81.
Site réalisé avec SPIP 3.0.17 + AHUNTSIC
Visiteurs connectés : 85