Poster un message
En réponse à :
Le tissu adipeux
1. Anatomie du TA
Il existe deux types de TA : le TA blanc et le TA brun, dont les rôles métaboliques sont distincts et complémentaires. Le TA blanc, formé principalement d’adipocytes blancs, accumule l’énergie en excès dans l’organisme sous forme de graisses et constitue ainsi le plus grand réservoir d’énergie chez les mammifères. Au contraire, le TA brun, dont la couleur est due à une irrigation plus dense et à un nombre important de mitochondries, est spécialisé dans la thermogenèse adaptative. Bien que le rôle du TA brun ait été beaucoup étudié chez les rongeurs et les nouveau-nés d’autres espèces, sa persistance et son importance chez les humains adultes sont activement étudiées et ses fonctions restent à déterminer.
La suite de cet article sera consacrée au TA blanc. Au sein du TA blanc, on trouve deux types de dépôts : le TA viscéral et le TA sous-cutané, qui possèdent des activités métaboliques et des sensibilités à l’insuline très différentes (Figure ci-dessus).
Le TA est composé majoritairement d’adipocytes matures remplis de lipides, ainsi que de leurs précurseurs les préadipocytes, et d’une fraction stroma-vasculaire qui contient des cellules sanguines, des cellules endothéliales et des macrophages .

1.1 Le TA blanc sous-cutané
Les dépôts sous-cutanés sont ceux qui subissent les plus importants changements de taille sans effet notable sur la sensibilité à l’insuline, le métabolisme du glucose ou le profil métabolique de l’organisme (Despres et al., 1989). Chez l’homme, il existe deux couches distinctes de TA sous-cutané : le TA sous-cutané superficiel et le TA sous-cutané profond. 51% du TA sous-cutané de la femme se trouvent dans les couches profondes de TA sous-cutané, alors que chez l’homme, ce sont 66% du TA sous-cutané total qui se trouvent dans cette couche.
L’épaisseur du TA sous cutané est variable selon les régions du corps et selon le sexe. Schématiquement, tout en étant réparti sur tout le corps, le TA sous cutané a tendance à se développer au dessus de la ceinture au niveau du ventre et des épaules chez l’homme, et chez la femme, en dessous de la ceinture au niveau des cuisses, des hanches et des fesses.
Il semblerait que l’obésité soit associée avec une augmentation préférentielle de la couche profonde, et la perte de poids chez les sujets obèses impacte préférentiellement cette couche, suggérant que la couche profonde sous-cutanée est plus active que la couche superficielle (He et al., 2005).
1.2 Le TA blanc viscéral
Le TA viscéral est constitué des compartiments intra- et rétropéritonéaux, et le TA intrapéritonéal est lui-même constitué du TA omental, mésentérique et, chez les rongeurs, périgonadal (épididymal). La délimitation entre les TA intra- et rétropéritonéaux est située le long de la surface ventrale du rein, et de la surface dorsale des intestins. Chez l’homme, le TA rétropéritonéal est minoritaire et ne représente que 25% du dépôt viscéral total (Wajchenberg, 2000). Le TA viscéral se distingue des autres dépôts par sa connexion directe au foie, via la veine porte.
Une diminution du TA viscéral améliore la sensibilité à l’insuline de l’organisme et induit le métabolisme du glucose. En fait, la masse de TA viscéral est positivement corrélée avec l’intolérance au glucose, l’altération du niveau plasmatique de lipoprotéines, l’augmentation des concentrations de triglycérides et de cholestérol, l’hypertension et la dyslipidémie (Thorne et al., 2002 ; Klein et al., 2004). De plus, l’analyse des voies de signalisation de l’insuline dans les TA viscéral et sous-cutané humains montre que le TA viscéral exprime des niveaux plus élevés de protéines spécifiques de la voie de signalisation de l’insuline et une plus grande sensibilité à l’insuline (Laviola et al., 2006). En bref, le TA viscéral est plus sensible à la perte de poids que le TA sous-cutané, plus actif métaboliquement, plus lipolytique et produit plus d’adipokines (Park and Lee, 2005).
2. Le TA et la régulation de l’homéostasie énergétique
Une des fonctions principales du TA est de stocker l’énergie en excès sous forme de lipides, qui sont ensuite mobilisées par d’autres tissus en réponse à des besoins métaboliques en périodes de restrictions alimentaires.
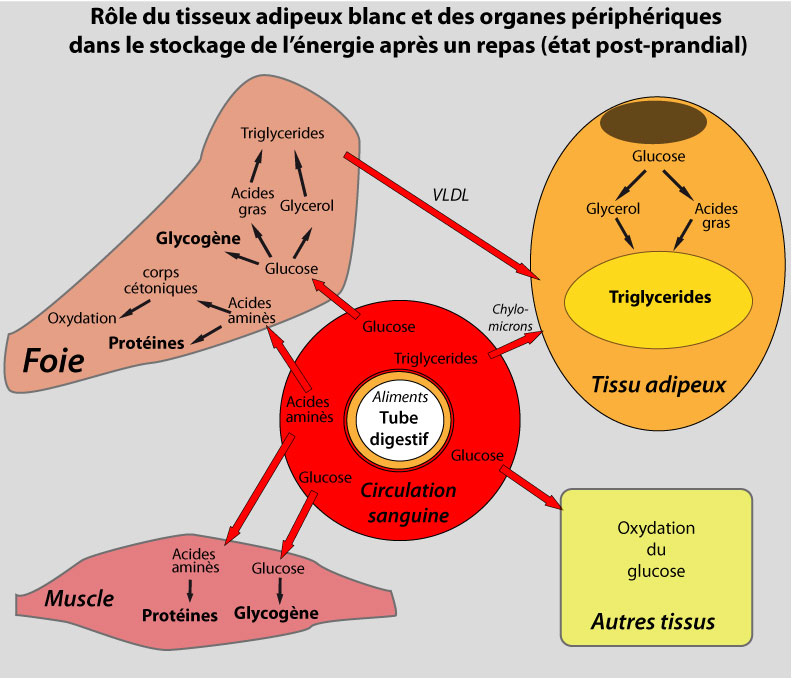
Après de copieux repas, le TA stocke l’énergie excédentaire sous forme de triglycérides (TG), c’est la lipogenèse. L’adipocyte est capable d’accumuler des quantités incroyablement élevées de TG, qui sont stockés au sein de gouttelettes lipidiques intracellulaires entourées de protéines appelées périlipines, sans causer de lipotoxicité (Greenberg et al., 1993).
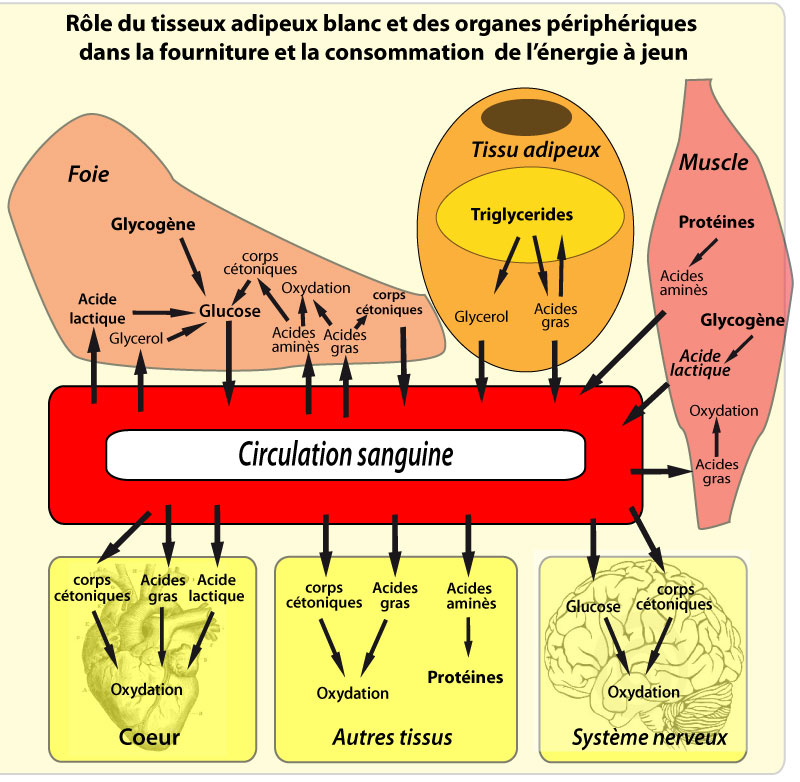
Le jeûne induit le catabolisme de ces TG en acides gras (AG) libres et en glycérol, qui sont libérés dans la circulation, c’est la lipolyse . Les AG libres servent ensuite de source énergétique pour des tissus actifs métaboliquement comme les muscles, où leur oxydation en CO2 et en eau génère de l’ATP. Une partie de ces AG libres peut cependant être réestérifiée directement dans le TA sans atteindre la circulation.
Dans le foie, la plupart de l’acétyl-CoA produit par l’oxydation des AG libres est utilisée pour synthétiser des corps cétoniques (acétoacétate, β-hydroxybutyrate), qui sont libérés dans la circulation et utilisés comme source d’énergie par les tissus périphériques. Le glycérol généré par l’hydrolyse des TG sert pour la synthèse de glucose, qui est réservé pour les cellules qui en dépendent comme source énergétique (neurones, globules rouges). La régulation des stocks de TG est cruciale pour la survie, puisque sans le TA et ses réserves lipidiques, les organismes auraient besoin de s’alimenter de façon continue, ce qui n’est évidemment pas possible.
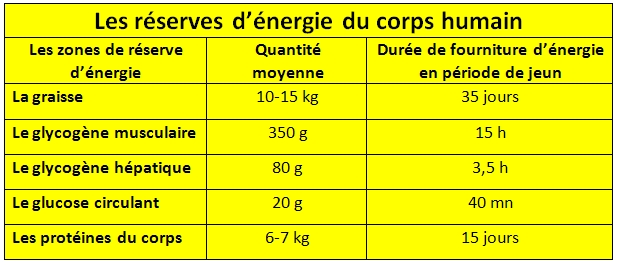
- La graisse accumulée au niveau du tissu adipeux représente la principale réserve d’énergie du corps humain
La régulation du métabolisme lipidique dans le TA est contrôlée à 3 niveaux : la captation des AG, la lipogenèse, et la lipolyse. Lipogenèse et lipolyse coexistent « au ralenti » : c’est le jeu de l’offre (en AG des chylomicrons et des lipoprotéines à très faibles densités (VLDL)) et de la demande (en AG par les tissus consommateurs) qui décide de la vitesse de l’une ou l’autre voie. Chacun de ces processus est contrôlé par des stimuli extérieurs dont l’insuline, les corticoïdes, les catécholamines, les peptides natriuretiques, et des cytokines comme le TNF-α.
3. Le TA, organe endocrinien
Longtemps considéré comme un organe inerte de stockage et de libération des lipides en fonction des besoins métaboliques, le TA apparaît aujourd’hui comme un véritable organe endocrinien capable d’intégrer des signaux hormonaux venant de différentes parties de l’organisme et d’y répondre en sécrétant ses propres peptides de signalisation appellés adipokines. Ces médiateurs ont un impact sur de nombreux tissus cibles, comme le foie ou les muscles squelettiques, et participent directement au contrôle général de la balance énergétique. Certaines de ces adipokines, comme la leptine ou l’adiponectine, activent des circuits neuronaux dans l’hypothalamus ou d’autres régions cérébrales avec un impact sur la régulation systémique de la dépense énergétique et le catabolisme lipidique (Ahima et al., 2006). En plus de la production de ces adipokines, le TA, en condition de stress, sécrète aussi des cytokines pro- ou anti-inflammatoires, avec des actions autocrines et/ou paracrines et qui contribuent aussi au contrôle de l’homéostasie énergétique. La production et la sécrétion de ces adipokines et de ces cytokines par le TA sont régulées par la masse adipeuse et le statut physiologique de l’organisme (Verreth et al., 2004).
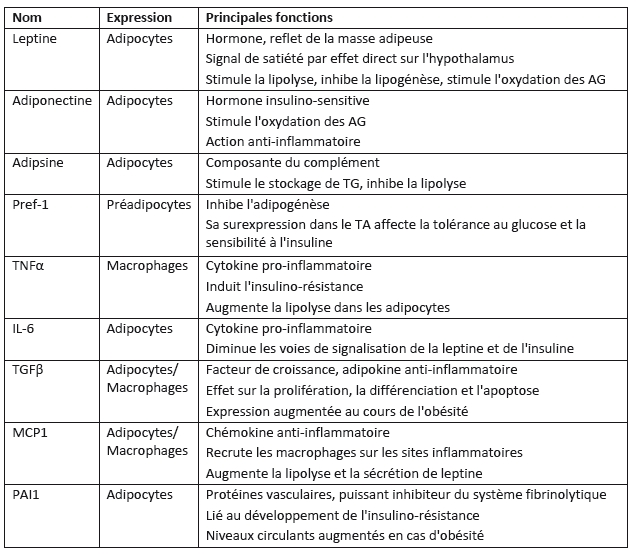
- Facteurs secrétés par le tissu adipeux
Bien que de nouvelles adipokines impliquées dans l’homéostasie énergétique ont été découvertes ces dernières années, les plus étudiées restent la leptine, l’adiponectine, la resistine, l’angiopoietin-like protein 4, et le preadipocyte factor 1. Les autres molécules sécrétées par le TA (chemokines, adipokines, protéines vasculaires) sont impliquées dans des réactions pro-inflammatoires (TNFα, IL1, IL6) ou anti-inflammatoire (TGFβ, IL1Rα, IL10, MCP1, IL8, RANTES, IP10, PAI1, TF, angiotensin 2).
4 Focus sur l’adipocyte
4.1 Morphologie
L’adipocyte blanc est composé pour l’essentiel d’une gouttelette de lipides. Le noyau est refoulé à la périphérie et le cytoplasme limité à une mince couronne autour des lipides intracellulaires.
Les adipocytes mettent en réserve les AG libres sous forme de TG qui sont stockés dans la gouttelette lipidique (lipogenèse). La taille des adipocytes peut varier grandement, jusqu’à 20 fois. A l’inverse, en cas de besoin énergétique, les TG sont hydrolysés, ce qui libère des AG libres dans la circulation (lipolyse).
4.2 Lipogenèse
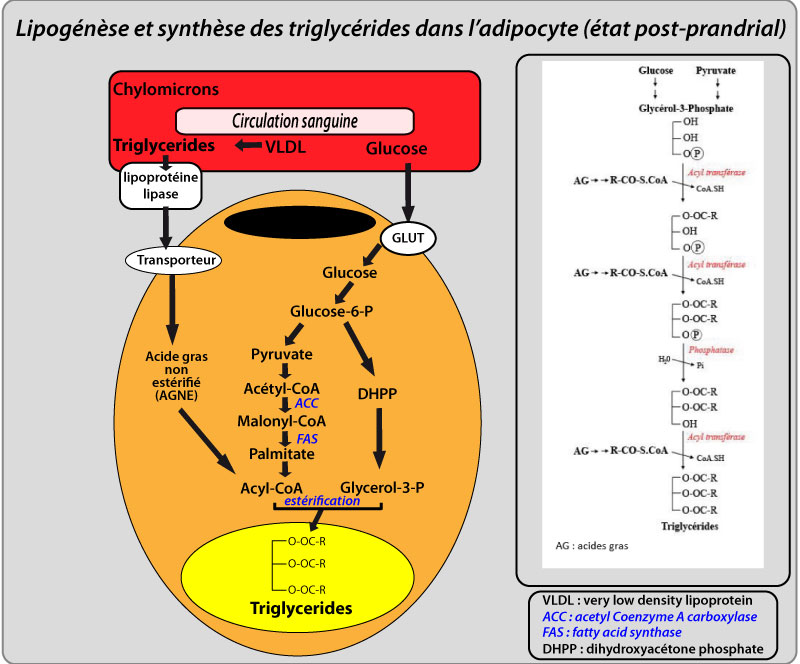
Les TG stockés dans les adipocytes sont synthétisés dans ces cellules à partir d’AG et de glycérol, l’un et l’autre devant être prélablement activés respectivement en acyl-CoA et en glycérol-3-phosphate (G3P). La plupart des AG utilisés pour cette synthèse proviennent des lipides plasmatiques circulants, tandis que le G3P peut avoir deux origines, la glycolyse et la glycéronéogenèse. Le site exact de la synthèse des TG et le moyen par lequel les nouveaux TG sont dirigés vers les gouttelettes lipidiques sont encore débattus.
4.2.1 Sources d’AG
La plupart des AG utilisés pour la synthèse de TG dans le TA humain provient des lipides plasmatiques circulants. Ces AG circulants sont, soit des AG non estérifiés (AGNE) liés à l’albumine, soit des TG incorporés dans des lipoprotéines, principalement des VLDL en état postabsortif et des chylomicrons en état post-prandial. Ces lipoprotéines doivent tout d’abord être hydrolysées par la lipoprotéine lipase (LPL), enzyme liée aux capillaires du TA (Mead et al., 2002), afin de libérer leurs AG. L’expression et l’activité de la LPL sont augmentées dans le TA à l’état nourri, particulièrement lors d’un régime riche en carbohydrates, probablement par l’action de l’insuline, tandis que son expression et son activité sont réduites en période de jeûne et sous régime riche en lipides (Braun and Severson, 1992).
Quelque soit leur origine, la captation des AG à longue chaîne par les adipocytes requiert des processus spécifiques pour leur permettre de traverser la membrane plasmique (Luiken et al., 2004). Il est probable qu’un transport par des transporteurs spécifiques et une diffusion passive coexistent. Les adipocytes blancs humains expriment différents transporteurs des AG, qui facilitent et contrôlent leur transport : la protéine Cluster of Differentiation 36 (CD36) (homologue du transporteur des AG murin Fatty Acid Transporteur (FAT)), la protéine de transport des AG (Fatty Acid Transport Protein, FATP), et la protéine de la membrane plasmique liant les AG (Fatty-Acid-Binding Protein, FABP), CD36 étant responsable de la majorité de la captation des AG (Ibrahimi and Abumrad, 2002). L’insuline favorise ce transport en stimulant l’expression de ces transporteurs et leur transport jusqu’à la membrane plasmique (Czech, 2002).
Les AG n’étant pas solubles dans le cytosol et pouvant avoir des effets toxiques sur les membranes, ils sont ensuite fermement liés par des protéines cytosoliques de liaisons aux lipides appelées FABP. Ces protéines transportent les AG de membranes en membranes jusqu’au site d’action de l’enzyme acyl-CoA synthase. Les adipocytes blancs humains expriment deux FABPs : adipocyte Protein 2 (aP2), produit du gène FABP4, exprimée uniquement dans les adipocytes et majoritaire, et la protéine de liaison des lipides des kératinocytes , exprimée aussi dans les macrophages, minoritaire (Fisher et al., 2002). Le premier pas du métabolisme des AG après leur captation et leur liaison aux FABP est leur activation en acyl-CoA à chaîne longue (Long Chain Fatty Acyl-CoA, LCFA-CoA) par l’acyl-CoA synthase (ACS). Les LCFA-CoA peuvent ensuite être dirigés vers l’oxydation ou dans la synthèse de lipides plus complexes comme les TG. Comme dans d’autres tissus, l’oxydation nécessite l’entrée des LCFA-CoA dans la mitochondrie par l’action de la carnitine-palmitoyl transférase I.
A part la captation d’AG circulants, une deuxième source d’AG est possible dans les adipocytes : la lipogenèse de novo. La lipogenèse de novo est la synthèse de nouvelles molécules d’AG à partir de substrats non lipidiques, principalement des carbohydrates chez les mammifères. L’expression et l’activité des chemins lipogénique et glycolitique sont ainsi intimement liées dans les tissus lipogéniques. Les deux principaux sites de lipogenèse de novo sont le foie et le TA. L’importance quantitative de ce phénomène, et les contributions respectives du foie et du TA varient selon les espèces. Globalement, la lipogenèse de novo est moins active chez l’homme que chez le rongeur et contribue bien moins aux stocks lipidiques de l’adipocyte que les TG alimentaires (Marin et al., 1992). Les enzymes clefs de la lipogenèse sont exprimées dans les adipocytes mais leur expression et leur activité sont plus faibles chez l’homme que chez le rat (Letexier et al., 2003). Il semble que la lipogenèse de novo chez l’homme soit moins active dans les adipocytes que dans le foie, exprimé par gramme de tissu, mais, en considérant l’organisme en entier, les contributions du foie (1.5 kg) et du TA (12 à 15 kg) sont comparables (1 à 2 grammes par jour pour chaque tissu) (Diraison et al., 2003). Elles restent cependant minoritaires comparées à l’ingestion des TG alimentaires (>100 g/jour).
4.2.2 Sources de G3P
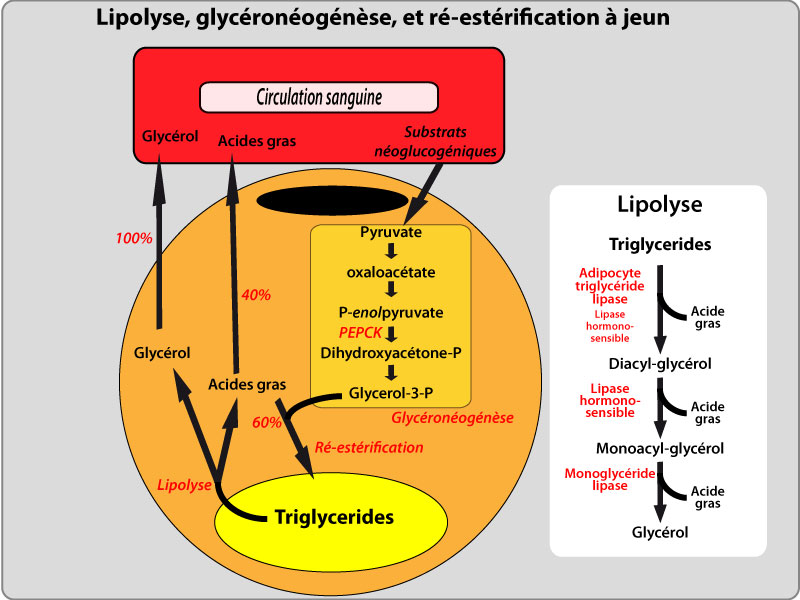
La synthèse de TG nécessite du G3P pour l’étape initiale de l’estérification des AG. L’activité de la glycérol-kinase est très faible dans les adipocytes, et le G3P est produit soit à partir de glucose, par les premières étapes de la glycolyse, soit à partir de précurseurs gluconéogeniques, par la glycéronéogenèse (Reshef et al., 2003). Le glucose entre dans les adipocytes à l’aide des transporteurs de glucose 1 et 4 (Glut-1 et Glut-4) responsables respectivement de l’entrée de glucose basale et stimulée par l’insuline. L’autre source de G3P est la glycéronéogenèse, une version abrégée de la gluconéogenèse qui produit du G3P à partir de substrats gluconéogeniques comme le lactate et le pyruvate. L’étape limitante de cette réaction est contrôlée par la forme cytosolique de la phosphoenol pyruvate carboxy kinase (PEPCK). Les contributions relatives de la glycolyse et de la glycéronéogenèse à la production de G3P varient en fonction de facteurs nutritionnels et pharmacologiques. La disponibilité globale de G3P contrôle le taux d’estérification des AG provenant de la lipogénèse de novo ou des lipides circulants, mais aussi la ré-estérification partielle des AG libérés lors de la lipolyse des TG.
4.2.3 Synthèse des TG
Les TG sont constituées d’une molécule de glycérol, liée à 3 molécules d’AG. La biosynthèse des TG résulte de l’estérification successive des groupes alcool du G3P par différentes enzymes : trois acyl transférases et une phosphatase qui forment la triglycéride synthase, complexe multienzymatique lié à la membrane du réticulum endoplasmique.
4.3 Lipolyse
Les TG du TA sont hydrolysés lorsque les besoins énergétiques de l’organisme ne sont pas satisfaits par l’alimentation. Lors de cette lipolyse intracellulaire, les TG sont hydrolysés successivement en diacylglycérols (DAG) et monoacylglycérols (MAG), pour aboutir finalement à la libération de 3 molécules d’AG et d’une molécule de glycérol par molécule de TG. Cette hydrolyse est généralement complète, même si quelques DAG et MAG peuvent d’accumuler. Le TA ayant une activité glycérol-kinase très faible, le glycérol produit est libéré dans la circulation pour être utilisé par d’autres tissus. Cette libération de glycérol dépend en partie de l’aquaporine (AQP), une protéine formant un canal dans la membrane plasmique. Les AG libérés par l’hydrolyse des TG, au contraire, peuvent être soit libérés dans la circulation, soit réestérifiés en TG sans apparaître dans la circulation. Ce recyclage intracellulaire d’AG dépend de la disponibilité en G3P, et de l’expression des enzymes de ré-estérification. A l’état basal, postabsorptif, ce recyclage est limité, mais le taux de ré-estérification augmente en période de jeûne, ou dans des situations pathologiques comme l’hyperthyroidisme (Beylot et al., 1991), ou le stress (Bahr et al., 1990). Ces mécanismes de régulation du taux de ré-estérification participent à la régulation des taux d’AG plasmatiques.
La lipase hormono-sensible (LHS) possède un rôle clef dans l’hydrolyse des TG. La lipolyse est activée par les hormones ou médiateurs activant le système adénylate cyclase (adrénaline, noradrénaline, glucagon), entrainant l’augmentation de la concentration intracellulaire en AMP cyclique, qui phosphoryle une protéine kinase A, qui à son tour active en les phosphorylant la LHS et les périlipines. L’inhibition de l’expression de la LHS chez la souris se traduit par l’accumulation de DAG au lieu de TG. Ceci suggère que, bien que la LHS soit capable d’hydrolyser les TG, ses substrats principaux sont les DAG.
L’adipose triglycéride lipase (ATGL), est une autre lipase présente dans le TA. L’inhibition simultanée de l’ATGL et de la LHS se traduit par une inhibition de plus de 90% de l’hydrolyse des TG dans le TA (Zimmermann et al., 2004). Ainsi, l’hydrolyse des TG est d’abord et majoritairement dépendante de l’ATGL, et accessoirement sous la dépendance de la LHS, l’hydrolyse des DAG est assurée par la LHS, puis une MAG lipase produit le dernier AG et un glycérol. Il est admis que la MAG lipase représente l’étape limitante de la libération de glycérol et d’AG libres.
5. Origine et développement du TA
Dans la plupart des espèces, la formation du TA adipeux débute avant la naissance. L’expansion du TA se déroule rapidement après la naissance par une augmentation du nombre et de la taille des cellules adipeuses, phénomènes appelés respectivement hyperplasie et hypertrophie. De nombreuses études suggèrent que l’expansion du TA à l’âge adulte ne résulte pas seulement de l’augmentation de la taille des adipocytes, mais aussi d’une augmentation de leur nombre. L’hyperplasie adipocytaire a en effet été observée dans de nombreux modèles murins (Okuno et al., 1998) (Gregoire, 2001). Même si l’existence de l’hyperplasie adipocytaire reste controversée chez l’homme, des précurseurs adipocytaires pouvant être différenciés in vitro en adipocytes ont été isolés de TA adulte humain (Sen et al., 2001), démontrant que la capacité à générer de nouvelles cellules adipocytaires persistait tout au long de la vie. De plus, des cellules dérivant de cellules de la fraction stroma-vasculaire de TA humain peuvent se différencier in vitro en cellules adipogénique, chondrogénique, myogénique et osteogénique en présence de facteurs d’induction spécifiques (Zuk et al., 2001), confirmant la plasticité du TA.
Cela suggère qu’en plus de cellules fibroblastiques déjà déterminées en adipocytes (les préadipocytes), le TA humain adulte contient des cellules précurseuses multipotentes. Cependant, les mécanismes moléculaires impliqués dans la détermination de cellules primitives au lignage adipocytaire sont encore mal connus. Au contraire, les évènements moléculaires et cellulaires qui permettent la transition des cellules indifférenciées fibroblastiques en adipocytes matures ont été très étudiés. Ce dernier phénomène est appelé différenciation ou adipogenèse.
6. La différenciation adipocytaire (adipogenèse)
Pendant la différenciation adipocytaire, l’acquisition du phenotype adipocytaire est caractérisée par des changements chronologiques dans l’expression de nombreux gènes. Cela se reflète par l’apparition de marqueurs précoces, intermédiaires et tardifs d’ARNm ou de protéines, et par l’accumulation de TG. Ces changements sont principalement transcriptionnels.
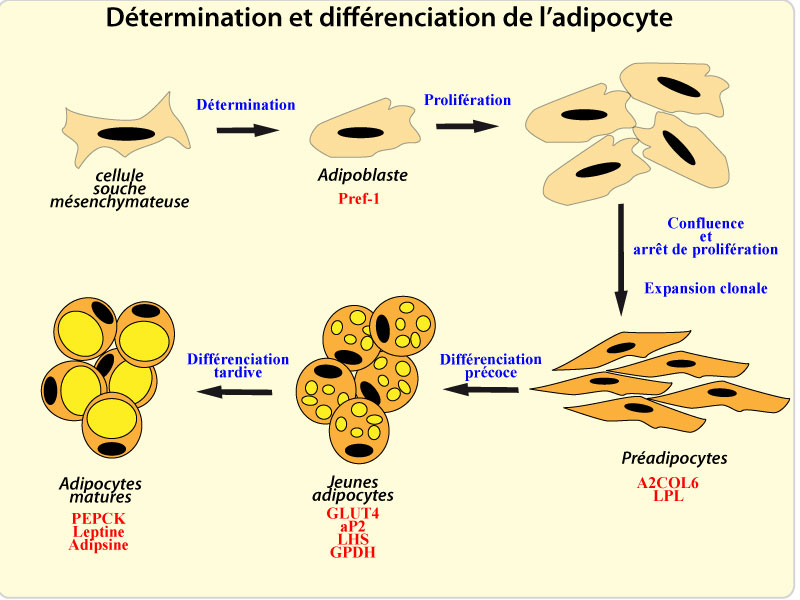
- Les différentes étapes de la différenciation adipocytaire sont écrites en bleu, les différents stades cellulaires sont en noir et les marqueurs caractéristiques de chaque stade sont en rouge.
Les changements dans l’expression de gènes pendant les phases précoces et tardives de la différenciation adipocytaires ont été principalement caractérisés en utilisant des lignées cellulaires de préadipocytes, comme la lignée murine 3T3-L1 qui sera présentée ci-après. Les principales étapes de la différenciation adipocytaire sont présentées ci-dessous. Pour une revue complète sur ce phénomène, voir (Gregoire et al., 1998).
6.1 Arrêt de la prolifération
Après une phase de croissance exponentielle (régulée par des facteurs mitogéniques), l’adipoblaste, qui présente un aspect fibroblastique, atteint un stade de confluence marqué par un arrêt de la prolifération. Plus que les phénomènes de contact cellulaire, cette interruption de croissance semble requise pour l’engagement vers la différenciation adipocytaire des adipoblastes qui deviennent alors des préadipocytes. Les deux facteurs de transcription CCAAT/Enhancer binding protein-α (C/EBP-α) et peroxisome proliferator-activated receptor γ (PPARγ), dont l’expression ne cesse d’augmenter au cours de la différenciation, semblent déjà jouer un rôle dans cet arrêt de la prolifération cellulaire, malgré leur niveau d’expression faible dans les préadipocytes. Ces préadipocytes arrêtés en phase G0/G1 du cycle cellulaire expriment des marqueurs précoces tels que la chaîne α2 du collagène de type VI (A2COL6) ou la LPL. C’est aussi à ce moment là que s’éteint l’expression de pref-1 (preadipocyte factor 1), protéine soluble ayant un effet inhibiteur sur la différenciation adipocytaire (Sul et al., 2000).
6.2 Expansion clonale
Les préadipocytes ne peuvent progresser dans la différenciation que s’ils subissent une phase d’expansion clonale, qui correspond à plusieurs cycles de mitoses postconfluentes (Tang et al., 2003). Cependant, les préadipocytes primaires issus de TA humain ne nécessitent pas de division cellulaire pour entrer dans le processus de différenciation (Entenmann and Hauner, 1996). Dans ces cellules, l’inhibition de la mitose avec de la cytosine arabinoside n’affecte pas le développement adipocytaire, indiquant que l’amplification clonale de cellules déterminées n’est pas une étape critique.
Ces deux phases, l’arrêt de la croissance et l’expansion clonale s’accompagnent par des changements complexes dans l’expression des gènes qui peuvent dépendre du modèle cellulaire et des protocoles de différenciation utilisés. L’expression de l’ARNm de la LPL a été souvent citée comme un marqueur précoce de la différenciation adipocytaire, mais l’expression de la LPL est spontanée dans les préadipocytes à confluence et ne dépend pas de l’addition des agents nécessaires à la différenciation. Ceci suggère que la LPL serait plutôt un marqueur de la phase d’arrêt de croissance des cellules, plutôt qu’une étape précoce de la différenciation.
Au moins deux familles de facteurs de transcription sont induites précocement lors de la différenciation adipocytaire : C/EBP et PPAR. L’expression précoce de C/EBP et PPAR est logique, sachant leur implication majeure dans la phase de différenciation terminale des cellules, par transactivation de gènes spécifiques des adipocytes. PPARγ est adipocyte spécifique, il est exprimé à des niveaux faibles mais détectables dans les préadipocytes, et son expression augmente rapidement après l’induction hormonale de la différenciation, jusqu’à atteindre un niveau maximal d’expression dans les adipocytes matures. Une induction transitoire de l’expression de C/EBP-β et C/EBP-δ précède l’induction de l’expression de PPARγ. La décroissance de l’expression de C/EBP-β et C/EBP-δ lors des stades précoces à moyen de la différenciation s’accompagne ensuite de l’induction de C/EBP-α. L’induction de C/EBP-α se déroule tout juste avant l’expression de gènes adipocytaires spécifiques.
Enfin, lors de la différenciation adipocytaire, les cellules passent d’un phénotype fibroblastique allongé à une cellule de forme sphérique, et des changements drastiques sont observés dans la morphologie cellulaire, les éléments du cytosquelette et les composants de la matrice extracellulaire . Une baisse de 90 et 95% de la synthèse de l’actine et de la tubuline sont observées dans les phases très précoces, ce phénomène représentant un évènement à part entière du processus de différenciation et non une conséquence de l’accumulation de lipides (Spiegelman and Farmer, 1982). De même, un switch dans l’expression des gènes de collagène est un évènement précoce de la différenciation adipocytaire, les concentrations de procollagène de type I et III diminuant lors de la différenciation des cellules 3T3-L1, et la sécrétion des collagènes de type IV augmentant (Weiner et al., 1989). Enfin, une augmentation de la production de chondroitin sulfate protéoglycanes (versican ) a aussi lieu (Calvo et al., 1991).
6.3 Phase terminale de différenciation
Lors de la phase terminale de différenciation, les adipocytes en culture augmentent fortement la lipogénèse de novo et acquièrent leur sensibilité à l’insuline. L’activité, la protéine et l’ARNm des enzymes impliqués dans le métabolisme des TG augmentent de 10 à 100 fois : ATP citrate lyase, enzyme malique, acétyl CoA carboxylase, stearoyl-CoA desaturase, glycérol-3- phosphate acyltransférase, glycérol-3-phosphate dehydrogénase, fatty acid synthase… Les transporteurs au glucose (GLUT4) et à l’insuline, ainsi que la sensibilité à l’insuline augmentent. D’autres gènes spécifiques de l’adipocyte voient leur expression augmenter : aP2, CD36, perilipine, adipsine, leptine, PEPCK…
Bibliographie
Revues
Anghel SI and Wahli W (2007) Fat poetry : a kingdom for PPAR gamma. Cell Res 17:486-511..
Articles
Ahima RS, Qi Y, Singhal NS, Jackson MB and Scherer PE (2006) Brain adipocytokine action and metabolic
regulation. Diabetes 55 Suppl 2:S145-154.
Bahr R, Hansson P and Sejersted OM (1990) Triglyceride/fatty acid cycling is increased after exercise.
Metabolism 39:993-999.
Beylot M, Martin C, Laville M, Riou JP, Cohen R and Mornex R (1991) Lipolytic and ketogenic fluxes in human hyperthyroidism. J Clin Endocrinol Metab 73:42-49.
Braun JE and Severson DL (1992) Regulation of the synthesis, processing and translocation of lipoprotein
lipase. Biochem J 287 ( Pt 2):337-347.
Calvo JC, Rodbard D, Katki A, Chernick S and Yanagishita M (1991) Differentiation of 3T3-L1 preadipocytes with 3-isobutyl-1-methylxanthine and dexamethasone stimulates cell-associated
and soluble chondroitin 4-sulfate proteoglycans. J Biol Chem 266:11237-11244.
Czech MP (2002) Fat targets for insulin signaling. Mol Cell 9:695-696.
Despres JP, Nadeau A, Tremblay A, Ferland M, Moorjani S, Lupien PJ, Theriault G, Pinault S and Bouchard C (1989) Role of deep abdominal fat in the association between regional adipose tissue distribution and glucose tolerance in obese women. Diabetes 38:304-309.
Diraison F, Yankah V, Letexier D, Dusserre E, Jones P and Beylot M (2003) Differences in the regulation of adipose tissue and liver lipogenesis by carbohydrates in humans. J Lipid Res 44:846-853.
Entenmann G and Hauner H (1996) Relationship between replication and differentiation in cultured human adipocyte precursor cells. Am J Physiol 270:C1011-1016.
Fisher RM, Thorne A, Hamsten A and Arner P (2002) Fatty acid binding protein expression in different human adipose tissue depots in relation to rates of lipolysis and insulin concentration in obese individuals. Mol Cell Biochem 239:95-100.
Greenberg AS, Egan JJ, Wek SA, Moos MC, Jr., Londos C and Kimmel AR (1993) Isolation of cDNAs for perilipins A and B : sequence and expression of lipid droplet-associated proteins of adipocytes. Proc Natl Acad Sci U S A 90:12035-12039
He Q, Engelson ES and Kotler DP (2005) A comparison of abdominal subcutaneous adipose tissue pattern in obese and lean HIV-infected women. J Nutr 135:53-57.
Ibrahimi A and Abumrad NA (2002) Role of CD36 in membrane transport of long-chain fatty acids. Curr Opin Clin Nutr Metab Care 5:139-145.
Klein S, Fontana L, Young VL, Coggan AR, Kilo C, Patterson BW and Mohammed BS (2004) Absence of an effect of liposuction on insulin action and risk factors for coronary heart disease. N Engl J Med 350:2549-2557.
Laviola L, Perrini S, Cignarelli A, Natalicchio A, Leonardini A, De Stefano F, Cuscito M, De Fazio M, Memeo V, Neri V, Cignarelli M, Giorgino R and Giorgino F (2006) Insulin signaling in human visceral and subcutaneous adipose tissue in vivo. Diabetes 55:952-961.
Letexier D, Pinteur C, Large V, Frering V and Beylot M (2003) Comparison of the expression and activity
of the lipogenic pathway in human and rat adipose tissue. J Lipid Res 44:2127-2134.
Luiken JJ, Coort SL, Koonen DP, van der Horst DJ, Bonen A, Zorzano A and Glatz JF (2004) Regulation of cardiac long-chain fatty acid and glucose uptake by translocation of substrate transporters. Pflugers Arch 448:1-15
Marin P, Hogh-Kristiansen I, Jansson S, Krotkiewski M, Holm G and Bjorntorp P (1992) Uptake of glucose carbon in muscle glycogen and adipose tissue triglycerides in vivo in humans. Am J Physiol 263:E473-480.
Mead JR, Irvine SA and Ramji DP (2002) Lipoprotein lipase : structure, function, regulation, and role in disease. J Mol Med 80:753-769.
Okuno A, Tamemoto H, Tobe K, Ueki K, Mori Y, Iwamoto K, Umesono K, Akanuma Y, Fujiwara T, Horikoshi H, Yazaki Y and Kadowaki T (1998) Troglitazone increases the number of small adipocytes without the change of white adipose tissue mass in obese Zucker rats. J Clin Invest 101:1354-1361.
Park HS and Lee K (2005) Greater beneficial effects of visceral fat reduction compared with subcutaneous fat reduction on parameters of the metabolic syndrome : a study of weight reduction programmes in subjects with visceral and subcutaneous obesity. Diabet Med 22:266-272.
Reshef L, Olswang Y, Cassuto H, Blum B, Croniger CM, Kalhan SC, Tilghman SM and Hanson RW (2003) Glyceroneogenesis and the triglyceride/fatty acid cycle. J Biol Chem 278:30413-30416.
Sen A, Lea-Currie YR, Sujkowska D, Franklin DM, Wilkison WO, Halvorsen YD and Gimble JM (2001) Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous. J Cell Biochem 81:312-319.
Spiegelman BM and Farmer SR (1982) Decreases in tubulin and actin gene expression prior to
morphological differentiation of 3T3 adipocytes. Cell 29:53-60.
Sul HS, Smas C, Mei B and Zhou L (2000) Function of pref-1 as an inhibitor of adipocyte differentiation. Int J Obes Relat Metab Disord 24 Suppl 4:S15-19.
Tang QQ, Otto TC and Lane MD (2003) Mitotic clonal expansion : a synchronous process required for adipogenesis. Proc Natl Acad Sci U S A 100:44-49.
Thorne A, Lonnqvist F, Apelman J, Hellers G and Arner P (2002) A pilot study of long-term effects of a novel obesity treatment : omentectomy in connection with adjustable gastric banding. Int J Obes Relat Metab Disord 26:193-199.
Verreth W, De Keyzer D, Pelat M, Verhamme P, Ganame J, Bielicki JK, Mertens A, Quarck R, Benhabiles N, Marguerie G, Mackness B, Mackness M, Ninio E, Herregods MC, Balligand JL and Holvoet P (2004) Weight-loss-associated induction of peroxisome proliferator-activated receptor-alpha and peroxisome proliferator-activated receptor-gamma correlate with reduced atherosclerosis and improved cardiovascular function in obese insulin-resistant mice. Circulation 110:3259-3269.
Wajchenberg BL (2000) Subcutaneous and visceral adipose tissue : their relation to the metabolic syndrome. Endocr Rev 21:697-738.
Weiner FR, Shah A, Smith PJ, Rubin CS and Zern MA (1989) Regulation of collagen gene expression in 3T3-L1 cells. Effects of adipocyte differentiation and tumor necrosis factor alpha. Biochemistry 28:4094-4099.
Zimmermann R, Strauss JG, Haemmerle G, Schoiswohl G, Birner-Gruenberger R, Riederer M, Lass A, Neuberger G, Eisenhaber F, Hermetter A and Zechner R (2004) Fat mobilization in adipose tissue
is promoted by adipose triglyceride lipase. Science 306:1383-1386.
Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, Benhaim P, Lorenz HP and Hedrick MH (2001) Multilineage cells from human adipose tissue : implications for cell-based therapies. Tissue Eng
7:211-228.
Site réalisé avec SPIP 3.0.17 + AHUNTSIC
Visiteurs connectés : 64